微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
简答题 硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在?????郊
区(填标号);
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,
该反应的化学方 程式为 ???????????????。
(3)为提高SO3吸收率,实际生产中通常用?????????吸收SO3。
(4)已知反应2SO2+O2 SO3?△H <0,现将0.050mol SO2和0.030mol O2
SO3?△H <0,现将0.050mol SO2和0.030mol O2
充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压
强缩小到原来压强的75%,则该条件下SO2的转化率为________;该条件下的
平衡常数为__________。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在
沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃
| 600
| 620
| 640
| 660
|
炉渣中CuSO4的质量分数/%
| 9.3
| 9.2
| 9.0
| 8.4
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随
温度升高而降低的原因??????????????????????????。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方
法可用??????(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产
水泥的辅料,写出这两步反应的化学方程式??????????。
简答题 硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在?????郊
区(填标号);
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,
该反应的化学方程式为 ???????????????。
(3)为提高SO3吸收率,实际生产中通常用?????????吸收SO3。
(4)已知反应2SO2+O2 SO3?△H <0,现将0.050mol SO2和0.030mol O2 SO3?△H <0,现将0.050mol SO2和0.030mol O2
充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压
强缩小到原来压强的75%,则该条件下SO2的转化率为________;该条件下的
平衡常数为__________。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在
沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃
| 600
| 620
| 640
| 660
| 炉渣中CuSO4的质量分数/%
| 9.3
| 9.2
| 9.0
| 8.4
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随
温度升高而降低的原因??????????????????????????。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方
法可用??????(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产
水泥的辅料,写出这两步反应的化学方程式?????????? 。
本题答案:(1)C?
(2)4CuFeS2+13O2![]() 本题解析:(1)从资源的利用、交通等考虑,选合适; 本题解析:(1)从资源的利用、交通等考虑,选合适;
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,
该反应的化学方程式为,4CuFeS2+13O2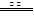 ?4CuO+2Fe2O3+8SO2 ?4CuO+2Fe2O3+8SO2
(3)为提高SO3吸收率,实际生产中通常用98.3%浓硫酸吸收,因为用水吸收,容易形成酸雾,阻碍了三氧化硫的吸收。
(4)已知反应2SO2+O2?2SO3△H<0,现将0.050mol SO2和0.030mol O2充入容积为1L的密闭容器中,反应在一定条件下达到平衡,设反应的二氧化硫物质的量为X:依据三段式列式:
2SO2 +???? O2?????? 2SO3
起始量(mol)????0.050?????0.030 ???0
变化量(mol)?????X?????????? 0.5X ??X
平衡量(mol)????0.05-X???0.03-0.5X ??X
测得反应后容器压强缩小到原来压强的75%,所以压强之比等于物质的量之比;则,0.05-X+0.03-0.5X+X=(0.050+0.030)×75%
解得:X=0.04mol;
则二氧化硫的转化率=0.04mol/0.05mol×100%=80%;
平衡状态物质的平衡浓度为:c(SO2)=0.01mol/L;c(O2)=0.01mol/L;c(SO3)=0.04mol/L;平衡常数K= C2(SO3)/[ C2(SO2)×C(O2)]= 0.042/[0.012×0.01]
=1.6×103;
(5)SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方
法可用生石灰除去,其步方程式为SO2+Ca(OH)2==CaSO3↓+H2O?,
CaSO3+H2SO4==CaSO4+SO2↑+H2O
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
He knows the water the best who has waded through it. 要知水深浅,须问过河人. |
|