微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 .(16分)Ⅰ.已知下列反应的热化学方程式为:
(1) C(s) + O2(g) = CO2(g)???????△H1 =" -393.5" kJ/mol
(2) CH3COOH(l) + 来源:91考试网 91exam.org2O2(g) = 2CO2(g) + 2H2O(l)??△H2 =" -870.3" kJ/mol
(3) 2H2(g) + O2(g) = 2H2O(l)??????△H3 =" -571.6" kJ/mol
请计算:2C(s) + 2H2(g) + O2(g)= CH3COOH(l)???△H4 = ????????????????????????。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2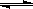 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)=??????。列式计算上述反应的平衡常数K = ??? 。
(2)有关反应:(t-BuNO)2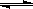 2(t-BuNO) 的叙述正确的是(????)
2(t-BuNO) 的叙述正确的是(????)
A.压强越大,反应物的转化率越大???? B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
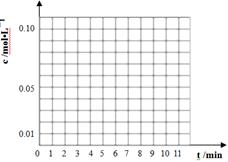
时间(min)
| 0
| 1
| 3
| 5
| 7
| 9
| 11
|
c(t-BuNO)2 mol/L
| 0.05
| 0.03
| 0.01
| 0.005
| 0.003
| 0.002
| 0.002
|
c(t-BuNO) mol/L
| 0
| 0.04
| 0.08
| 0.07
| 0.094
| 0.096
| 0.096
Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液。则通甲醇的电极反应式为??????????????????????????????????。若通空气的电极上有32g O2参加反应,则反应过程中转移了???????mol e-。
填空题 .(16分)Ⅰ.已知下列反应的热化学方程式为:
(1) C(s) + O2(g) = CO2(g)???????△H1 =" -393.5" kJ/mol
(2) CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l)??△H2 =" -870.3" kJ/mol
(3) 2H2(g) + O2(g) = 2H2O(l)??????△H3 =" -571.6" kJ/mol
请计算:2C(s) + 2H2(g) + O2(g)= CH3COOH(l)???△H4 = ????????????????????????。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2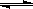 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体 积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)=??????。列式计算上述反应的平衡常数K = ??? 。
(2)有关反应:(t-BuNO)2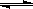 2(t-BuNO) 的叙述正确的是(????) 2(t-BuNO) 的叙述正确的是(????)
A.压强越大,反应物的转化率越大???? B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。

|