微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 440℃时2SO2(g) + O2(g) 2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g) 91ExAm.org,经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g) 91ExAm.org,经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
?
| 甲
| 乙
| 丙
|
起始物质的量
| n(SO2) / mol
| 0.4
| 0.8
| 0.8
|
n(O2) / mol
| 0.24
| 0.24
| 0.48
|
SO2的平衡转化率
| 80%
| α1
| α2
下列判断中,错误的是
A.甲中SO2的速率为0.032mol·L-1·min-1???B.440℃时,平衡常数K=400
C.温度高于440℃时,平衡常数K>400?????? D.平衡时,SO2的转化率:α1<80%<α2
选择题 440℃时2SO2(g) + O2(g) 2SO3(g) △H= -198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。 2SO3(g) △H= -198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
?
| 甲
| 乙
| 丙
| 起始物质的量
| n(SO2) / mol
| 0.4
| 0.8
| 0.8
| n(O2) / mol
| 0.24
| 0.24
| 0.48
| SO2的平衡转化率
| 80%
| α1
| α2
下列判断中,错误的是
A.甲中SO2的速率为0.032mol·L-1·min-1???B.440℃时,平衡常数K=400
C.温度高于440℃时,平衡常数K>400?????? D.平衡时,SO2的转化率:α1<80%<α2
本题答案:C
本题解析:
试题分析:A、平衡时消耗SO2的物质的量是0.4mol×0.8=0.32mol,浓度是0.32mol÷2L=0.16mol/L,因此甲中SO2的速率为0.16mol/L÷5min=0.032mol·L-1·min-1,A不正确;B、平衡时SO2的浓度是0.08mol/L÷2L=0.04mol/L,三氧化硫的浓度是0.16mol/L,氧气的浓度是(0.24mol-0.16mol)÷2L=0.04mol/L,所以该温度下反应的平衡常数K=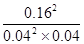 ?=400,B正确;C、正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,C不正确;D、乙容器相当于是在甲容器的基础上增大二氧化硫的浓度,二氧化硫的转化率降低;丙容器相当于是在甲容器的基础上增大压强,平衡向正反应方向移动,二氧化硫的转化率增大,D正确,答案选C。 ?=400,B正确;C、正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,C不正确;D、乙容器相当于是在甲容器的基础上增大二氧化硫的浓度,二氧化硫的转化率降低;丙容器相当于是在甲容器的基础上增大压强,平衡向正反应方向移动,二氧化硫的转化率增大,D正确,答案选C。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
Don't tell me how hard you work. Tell me how much you get done. 不必告诉我你多么勤奋,只要告诉我你做了多少事. |
|