微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (15分)“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(l)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
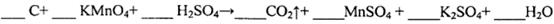
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 ,得到如下两组数据:
,得到如下两组数据:
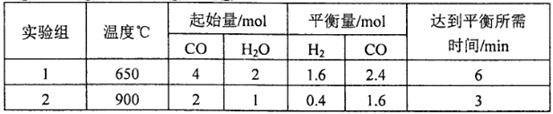
①实验2条件下平衡常数K= __________。
②实验3,若 900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时
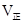 ____________
____________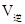 (填“<”,“>”,“=”)。
(填“<”,“>”,“=”)。
③由两组实验结果,可判断该反应的正反应△H_____________0(填“<”,‘‘>”,“=”)。
(3)己知在常温常压下:
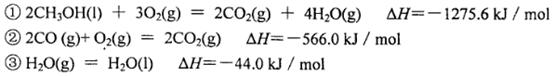
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________________
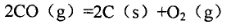
①已知该反应的△H>0,简述该设想能否实现的依据:________。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8× 10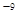 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10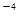 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。
mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__________mol/L。
填空题 (15分)“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(l)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
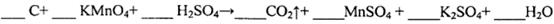
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 ,得到如下两组数据:
,得到如下两组数据:

①实验2条件下平衡常数K= __________。
②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时
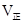 ____________
____________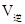 (填“<”,“>”,“=”)。
(填“<”,“>”,“=”)。
③由两组实验结果,可判断该反应的正反应△H_____________0(填“<”,‘‘>”,“=”)。
(3)己知在常温常压下:
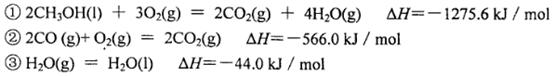
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________________
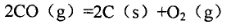
①已知该反应的△H>0,简述该设想能否实现的依据:________。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8× 10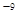 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10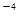 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__ www.91exAm.org________mol/L。
mol/L,则生成沉淀所需CaCl2溶液的最小浓度为__ www.91exAm.org________mol/L。
本题答案:(1)5、4、6、5、4、2、6;(2)①0.17;②<
本题解析:
试题分析:(l)该反应是氧化还原反应。根据氧化还原反应中电子转移数目与化合价升降总数相等可得该反应的方程式,配平为5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O;(2) ①实验2条件下平衡常数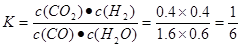 =0.17。②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,由于生成物的浓度增大的多于反应物增大的浓度,因此在此时
=0.17。②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,由于生成物的浓度增大的多于反应物增大的浓度,因此在此时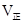 <
<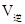 。③在实验1条件下平衡常数
。③在实验1条件下平衡常数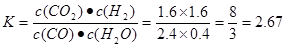 可见升高温度,化学平衡常数减小。说明升高温度,平衡逆向移动。根据平衡移动原理。升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,实验正反应为放热反应。因此该反应的正反应△H<0。(3) (①-②)÷2+③×2,整理可得CH3OH(l)+O2(g)=CO(g)+2H2O(l)???H= -442.8KJ/mol;①由已知条件可知:该反应是焓增、熵减的反应,所以在任何温度下均不能自发进行;②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,使其转化为无毒的大气的成分。该反应的化学反应方程式为2CO+2NO
可见升高温度,化学平衡常数减小。说明升高温度,平衡逆向移动。根据平衡移动原理。升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,实验正反应为放热反应。因此该反应的正反应△H<0。(3) (①-②)÷2+③×2,整理可得CH3OH(l)+O2(g)=CO(g)+2H2O(l)???H= -442.8KJ/mol;①由已知条件可知:该反应是焓增、熵减的反应,所以在任何温度下均不能自发进行;②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,使其转化为无毒的大气的成分。该反应的化学反应方程式为2CO+2NO 2CO2+N2;(5) Ksp=c(Ca2+)·c(CO32-)=2.8×10
2CO2+N2;(5) Ksp=c(Ca2+)·c(CO32-)=2.8×10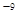 .由于溶液等体积混合后离子的浓度都减小一半,混合后c(CO32-)=5×10-5mol/L,所以Ca2+离子浓度的最小值是1/2c(Ca2+)×1/2×1×10
.由于溶液等体积混合后离子的浓度都减小一半,混合后c(CO32-)=5×10-5mol/L,所以Ca2+离子浓度的最小值是1/2c(Ca2+)×1/2×1×10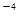 ≥2.8×10
≥2.8×10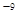 .解得c(Ca2+)≥1.12×10-4mol/L。
.解得c(Ca2+)≥1.12×10-4mol/L。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
A little help is worth a deal of pity. 一点帮助胜于一车同情.