微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
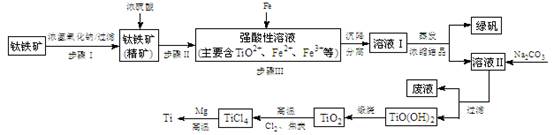
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式:?????????????????、??????????????????。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,
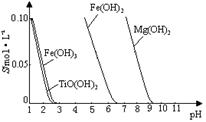
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因??是?????????? ????????。
② TiO2+水解的离子方程式为?????????????????。
向溶液II中加入Na2CO3粉末的作用是???????。
当溶液pH= ??????时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于???????℃即可。