微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
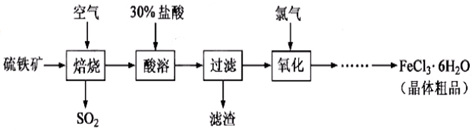
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为K= ????????;过量的SO2与NaOH溶液反应的化学方程式为?????????????????????????? ???
2SO3(g) ,该反应的平衡常数表达式为K= ????????;过量的SO2与NaOH溶液反应的化学方程式为?????????????????????????? ???
(2)酸溶及后续过程中均需保持盐酸过量,其目的是??????、???????。
(3)通氯气氧化后时,发生的主要反应的离子方程式为???????;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 ???????(写化学式)。
实验题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为K= ????????;过量的SO2与NaOH溶液反应的化学方程式为?????????????????????????????
2SO3(g) ,该反应的平衡常数表达式为K= ????????;过量的SO2与NaOH溶液反应的化学方程式为?????????????????????????????
(2)酸溶及后续过程中均需保持盐酸过量,其目的是??????、???????。
(3)通氯气氧化后时,发生的主要反应的离子方程式为???????;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 ???????(写化学式)。
本题答案:(1)根据化学平衡常数概念写出平衡常数表达式;在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) 2SO3(g) ,该反应的平衡常数表达式为
2SO3(g) ,该反应的平衡常数表达式为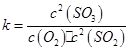 ;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程为载体考查平衡常数表达式的书写、物质的分离和提纯。
;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程为载体考查平衡常数表达式的书写、物质的分离和提纯。
本题所属考点来源:91考试网:【反应速率与平衡的有关计算】
本题难易程度:【一般】
Birds of a feather flock together. 物以类聚,人以群分.