微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (13分).Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如下图(a为活塞,加热及固定装置已略去)

①连接仪器、??????????????、加药品后,来源:91考试网 www.91exAm.org打开a,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是:
???????????????????????????????????????????????????????????。
③从品红溶液中观察到的现象说明SO2具有?????????????????性。??
④高锰酸钾溶液中的实验现象是??????????????????????????。
Ⅱ、上述实验中NaOH溶液用于吸收剩余的SO2生成Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性中Br2氧化Na2SO3的离子方程式????????
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1 Ba(NO3)2;
0.1 mol·L-1 AgNO3;CCl4;新制饱和氯水。
编号
| 实验操作
| 预期现象和结论
|
步骤①
| ?
| 有白色沉淀生成,证明待测液中含SO42-。
|
步骤②
| ?
| ?
|
步骤③
| ?
| ?
|
……
| ?
| ?
填空题 (13分).Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如下图(a为活塞,加热及固定装置已略去)

①连接仪器、??????????????、加药品后,打开a,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是:
???????????????????????????????????????????????????????????。
③从品红溶液中观察到的现象说明SO2具有?????????????????性。??
④高锰酸钾溶液中的实验现象是??????????????????????????。
Ⅱ、上述实验中NaOH溶液用于吸收剩余的SO2生成Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性中Br2氧化Na2SO3的离子方程式????????
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1 Ba(NO3)2;
0.1 mol·L-1 AgNO3;CCl4;新制饱和氯水。
编号
| 实验操作
| 预期现象和结论
| 步骤①
| ?
| 有白色沉淀生成,证明待测液中含SO42-。
| 步骤②
| ?
| ?
| 步骤③
| ?
| ?
| ……
| ?
| ?
本题答案:(共13分)Ⅰ、①检验装置气密性(1分)
② Cu +
本题解析:考查SO2气体的制取及性质、离子的检验
Ⅰ、①装置连接好后,必须检验装置的气密性
②Cu + 2H2SO4(浓)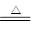 ?CuSO4 + SO2↑+ 2H2O ?CuSO4 + SO2↑+ 2H2O
③SO2可与某些有色物质形成不稳定的无色物质,使其褪色,表现为漂白性
④SO2还原性较强,可还原高锰酸钾溶液,使其由紫色转变为无色
Ⅱ、(1)碱性情况下,Br2氧化Na2SO3为Na2SO4,而Br2被还原为Br-,故反应的离子为:SO32- + Br2 + OH-? =? H2O? + SO42- + Br-,再根据化合价的升降守恒可得:SO32- + Br2 + OH-? =? H2O? + SO42- + 2Br-,最后结合电荷守恒及原子守恒可配平为:SO32- + Br2 + 2 OH-? =? H2O? + SO42- + 2Br-
(2)为了防止其它离子的干扰,SO42-的检验必须为:取少量待测液,加入过量的盐酸,再滴加适量BaCl2溶液,如若有白色沉淀生成,则证明SO42-的存在
而Br-的检验,一般是通过采用加入氧化剂,将其氧化为溴单质,根据溴水的颜色可溴在有机溶剂中的颜色来判定,但为防止同样有强还原性的SO32-离子的干扰,首先也需要加酸将其除去,故
方法1:取出步骤①中适量上层清液于试管中,加入适量氯水,观察溶液的颜色。(若再加入四氯化碳,振荡,静置后观察颜色也可)
方法2:另取少量待测液加入试管中,加入足量的盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色。(若再加入四氯化碳,振荡,静置后观察颜色也可)
本题所属考点:【探究性实验的设计与评价】
本题难易程度:【简单】
91ExAm.org
When patterns are broken,new worlds can emerge. 打破固定的模式,新世界才能出现。/ 破旧立新。 |
|