微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (16分)(一)某同学在一只烧杯里装入一定量的纯铁粉,加入20 0mL 6mol/L的硝酸,铁粉恰好溶解,请探究产物中铁元素价态:
(1)提出假设:
假设1:产物只有+2价铁;
假设2:___________________________________;
假设3:___________________________________。
(2)设计实验:取反应所得溶液分别装入甲、乙两支试管,在甲中滴加酸性KMnO4溶液;在乙中滴加KSCN溶液,观察现象,推测实验现象与结论:
①若现象为____________________,则假设1正确;
②若现象为____________________,则假设2正确;
③若现象为____________________,则假设3正确。
(二)、氯化铁是常见的水处理剂,工业上制备无水FeCl3的流程为:
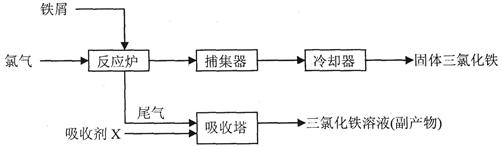
(3)吸收剂X为FeCl2溶液,其与尾气Cl2反应的离子方程式__________________。
(4)称取上述样品m克溶于25mL稀盐酸,用蒸馏水配成50mL溶液,加入稍过量的KI溶液充分反应: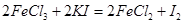 ,用淀粉作指示剂,用
,用淀粉作指示剂,用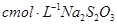 溶液进行滴定
溶液进行滴定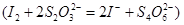 ,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56? Cl:35.5)
,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56? Cl:35.5)
(5)用FeCl3溶液(32%-35%)腐蚀铜板电路时所得废液含FeCl3、FeCl2和CuCl2,若用化学方法回收废液中的铜,简述操作要点:___________________________________________________。
实验题 (16分)(一)某同学在一只烧杯里装入一定量的纯铁粉,加入200mL 6mol/L的硝酸,铁粉恰好溶解,请探究产物中铁元素价态:
(1)提出假设:
假设1:产物只有+2价铁;
假设2:___________________________________;
假设3:___________________________________。
(2)设计实验:取反应所得溶液分别装入甲、乙两支试管,在甲中滴加酸性KMnO4溶液;在乙中滴加KSCN溶液,观察现象,推测实验现象与结论:
①若现象为____________ www.91exAm.org________,则假设1正确;
②若现象为____________________,则假设2正确;
③若现象为____________________,则假设3正确。
(二)、氯化铁是常见的水处理剂,工业上制备无水FeCl3的流程为:

(3)吸收剂X为FeCl2溶液,其与尾气Cl2反应的离子方程式__________________。
(4)称取上述样品m克溶于25mL稀盐酸,用蒸馏水配成50mL溶液,加入稍过量的KI溶液充分反应: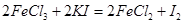 ,用淀粉作指示剂,用
,用淀粉作指示剂,用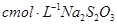 溶液进行滴定
溶液进行滴定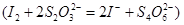 ,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56? Cl:35.5)
,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56? Cl:35.5)
(5)用FeCl3溶液(32%-35%)腐蚀铜板电路时所得废液含FeCl3、FeCl2和CuCl2,若用化学方法回收废液中的铜,简述操作要点:___________________________________________________。
本题答案:(1)假设2:产物中只有+3价铁元素(1分)
假设3:
本题解析:(1)由于铁的价态是+2价或+3价,所以分别是假设2:产物中只有+3价铁元素;假设3:产物中既有+2价又有+3价铁元素。
(2)①由于亚铁离子具有还原性,所以如果假设I正确,则现象是甲试管溶液紫色褪去,乙试管没有明显变化。
②如果是假设Ⅱ正确,则铁离子能和KSCN溶液发生显色反应,因此现象是甲试管溶液无明显变化,乙试管溶液变红色。
③如果是假设Ⅲ正确,则现象就是甲试管溶液颜色褪去,乙试管溶液变红色。
(3)氯气具有氧化性,能氧化氯化亚铁,生成氯化铁,方程式为Cl2+2Fe2+=2Cl-+2Fe3+。
(4)根据方程式可知,FeCl3~Na2S2O3,所以氯化铁的物质的量是0.001cVmol,所以样品中FeCl3的质量分数为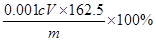 。
。
(5)要回收铜,则应该加入过量的铁粉,置换出铜,过量的铁用盐酸溶解即可。所以正确的操作是加过量Fe粉,将所得固体用过量盐酸溶解残留的铁粉,过滤、洗涤、干燥。
留的铁粉,过滤、洗涤、干燥。(2分)
本题所属考点:【物质组成与性质实验方案的设计】
本题难易程度:【一般】
He is lifeless that is faultless. 只有死人才无错误。 /人孰无过。