微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3???假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__????????????。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由?????????????.
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式??????????。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg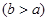 ,则混合物中Cu2O的质量分数为?????????。
,则混合物中Cu2O的质量分数为?????????。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4 ·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
物?质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1.4
|
沉淀完全pH
| 13
| 14
| 3.7
?
实验室有下列试剂可供选择: A.氯水? B.H2O2? C.NaOH ??? D.Cu2(OH)2CO3
实验小组设计如下实验方案:
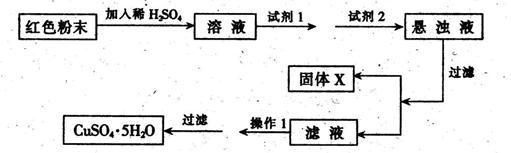
试回答:①试剂1为___????????_,试剂2为???????????(填字母)。
②固体X的化学式为____,③操作I为_??????????。
实验题 三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3???假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__????????????。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由?????????????.
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式??????????。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg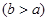 ,则混合物中Cu2O的质量分数为?????????。 ,则混合物中Cu2O的质量分数为?????????。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
物?质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
| 开始沉淀pH
| 6.0
| 7.5
| 1.4
| 沉淀完全pH
| 13
| 14
| 3.7
?
实验室有下列试剂可供选择: A.氯水? B.H2O2? C.NaOH ??? D.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂1为___????????_,试剂2为???????????(填字母)。
②固体X的化学式为____,③操作I为_??????????。
本题答案:
(1)固体完全溶解,溶液变为红色;(2)不合理???
本题解析:
试题分析:(1)若红色粉末是Fe2O3,Fe2O3与硫酸反应生成硫酸铁,没有红色不溶物,滴加KSCN溶液,溶液变为红色;(2)红色粉末若是Fe2O3和Cu2O的混合物,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,滴加KSCN试剂后溶液可能不变红色,所以说法不合理;(3)因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+;溶液不变红,且无固体残留,即为恰好完全反应,氧化铁和氧化亚铜的物质的量比值为1:1,质量比:10:9。
(4)Cu2O~~~2CuO?质量增重△w??
144 g??????????????????? 16 g?
m(Cu2O)???????????????(b-a) g?
所以m(Cu2O)=[144g×(b?a)g ]:16g =9(b-a)g,
故混合物中Cu2O的质量分数为[9(b?a) ]/a ×100%;
(5)红色粉末为Fe2O3和Cu2O的 混合物,由工艺流程可知,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,所得的溶液含有Fe2+,加入试剂1目的是Fe2+将为Fe3+,氯气会引入氯离子,故试剂1应选择B.H2O2;加入试剂2目的是调节溶液的PH值使Fe3+转化为Fe(OH)3沉淀除去,过滤得到硫酸铜溶液,氢氧化钠会引入钠离子,故试剂2应选择Cu2(OH)2CO3,得到的沉淀x为Fe(OH)3,接下来蒸发浓缩,冷却结晶。
本题所属考点:【物质组成与性质实验方案的设计】
本题难易程度:【一般】
The highest branch is not the safest roost. 高枝非良栖之所。 |
|