微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O可用于摄影和蓝色印刷。实验室制备草酸合铁酸钾晶体的实验流程如下:
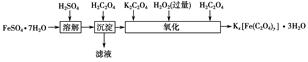
(1)若用铁和稀硫酸制备FeSO4·7H2O,常保持______过量,理由是___________________________________________________。
(2)上述流程中,“沉淀”一步所得FeC2O4·2H2O沉淀需用水洗涤。检验沉淀是否洗涤干净的方法是_________________________________________________________________。
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O42-含量的实验步骤如下:
步骤1:准确称取所制草酸合铁酸钾晶体a g(约1.5 g),配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入6 mol·L-1 HCl 10 mL,加热至70~80 ℃,趁热用SnCl2TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10 mL,在75~80 ℃下用0.010 00 mol·L-1 KMnO4标准溶液滴定至终点(Cl-不参与反应),将C2O42- 全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积。
步骤3:……
步骤4:重复上述步骤2~步骤3两次。
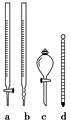
①步骤2操作时,还需要使用如图所示仪器中的________(填序号)。
②步骤2中MnSO4溶液的作用是________,滴定终点的现象是______________________________________。
③在不增加试剂种类的前提下,步骤3的目的是_________________________。
实验题 草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O可用于摄影和蓝色印刷。实验室制备草酸合铁酸钾晶体的实验流程如下:

(1)若用铁和稀硫酸制备FeSO4·7H2O,常保持______过量,理由是___________________________________________________。
(2)上述流程中,“沉淀”一步所得FeC2O4·2H2O沉淀需用水洗涤。检验沉淀是否洗涤干净的方法是_________________________________________________________________。
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O42-含量的实验步骤如下:

步骤1:准确称取所制草酸合铁酸钾晶体a g(约1.5 g),配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入6 mol·L-1 HCl 10 mL,加热至70~80 ℃,趁热用SnCl2TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10 mL,在75~80 ℃下用0.010 00 mol·L-1 KMnO4标准溶液滴定至终点(Cl-不参与反应),将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积。
步骤3:……
步骤4:重复上述步骤2~步骤3两次。
①步骤2操作时,还需要使用如图所示仪器中的________(填序号)。
②步骤2中MnSO4溶液的作用是________,滴定终点的现象是______________________________________。
③在不增加试剂种类的前提下,步骤3的目的是_________________________。
本题答案:(1)铁 防止Fe2+被氧气氧化
(2)取少量最后一次
本题解析:(1)铁和稀硫酸制备FeSO4·7H2O,保持一种物质过量,主要是硫酸,因为在获得晶体的过程中抑制Fe2+的水解。(2)沉淀洗涤是否干净,主要是沉淀中所含的可溶性杂质是否存在,首先分析杂质可能是K2SO4,可以通过检验SO42-检验洗涤是否干净。(3)①注意测定过程中要控制温度,选择温度计,方法是通过利用KMnO4滴定,选用酸式滴定管。②滴定过程中MnO4-被还原为Mn2+,先加入Mn2+可能是作催化剂。滴定终点时,KMnO4过量,此时溶液呈浅红色,且半分钟内不褪色。③本实验的目的是测定Fe3+和C2O42-,而测定过程中,是先将Fe3+还原为Fe2+,然后利用KMnO4滴定氧化Fe2+、C2O42-,无法分别出Fe2+、C2O42-各自的量,只有总量,因 此还需要滴定出Fe2+或C2O42-,由题可知滴定C2O42-更容易,因为可以另取溶液,直接滴定,因为此时铁为Fe3+不与KMnO4反应。
本题所属考点:【物质组成与性质实验方案的设计】
本题难易程度:【一般】
A man who fears suffering is already suffering from what he fears. 害怕痛苦的人已经在承受他所害怕的痛苦了。