微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (15分)浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样中的COD。主要的实验装置、仪器及具体操作步骤如下:
实验装置及仪器:

操作步骤:
①用仪器c将20.00mL水样置于250mL锥形瓶中,加入数粒碎瓷片。
②在水样中加入重铬酸钾标准溶液10.00mL,安装回流装置(如上图所示),从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应。
③冷却后加指示剂2d,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。
已知:Cr2O72—+14H++6Fe2+=6Fe3++2Cr3++7H2O
请你回答下列问题:
(1)仪器c的名称:??????????;用仪器c吸取液体时,左手拿洗耳球,右手将仪器c插入溶液中吸取,当???????????时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。
(2)下列有关操作不正确的是???????????(用相应编号填写)
A.用硫酸亚铁铵溶液滴定时需上述仪器中的仪器b
B. 仪器c在使用时需要先用待取液进行润洗,管尖残留的液体一般不要吹出
C.加入数粒碎瓷片的作用是可以防止液体暴沸
D.上述操作步骤③中在滴定时判断滴定终点的指示剂可以是甲基橙
E.加热回流结束后,要用蒸馏水对冷凝管管壁进行冲洗
(3)在加热回流过程中,可以用水浴作为恒温加热源吗?同时请说明理由。???????
(4)下列因素对测定水样中的COD能产生影响的有??????(用相应编号填写)
①硫酸的用量???????? ②反应装置中的锥形瓶在反应前用蒸馏水洗涤?
③重铬酸钾的用量???? ④回流时间的长短
(5)实验室配制重铬酸钾标准溶液的主要步骤及装置如下所示:
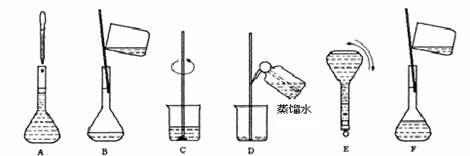
将上述实验步骤A到F按实验过程先后次序排列????????????????????
(6)已知:重铬酸钾标准溶液的c(Cr2O72—)=0.0250mol·L—1,硫酸亚铁铵溶液的c(Fe2+)=0.0100 mol·L—1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为12.00mL,则按上述实验方法,测得的该水样的化学需 91Exam.org氧量CODCr(O2)=???????mg/L
实验题 (15分)浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样中的COD。主要的实验装置、仪器及具体操作步骤如下:
实验装置及仪器:

操作步骤:
①用仪器c将20.00mL水样置于250mL锥形瓶中,加入数粒碎瓷片。
②在水样中加入重铬酸钾标准溶液10.00mL,安装回流装置(如上图所示),从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应。
③冷却后加指示剂2d,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。
已知:Cr2O72—+14H++6Fe2+=6Fe3++2Cr3++7H2O
请你回答下列问题:
(1)仪器c的名称:??????????;用仪器c吸取液体时,左手拿洗耳球,右手将仪器c插入溶液中吸取,当???????????时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。
(2)下列有关操作不正确的是???????????(用相应编号填写)
A.用硫酸亚铁铵溶液滴定时需上述仪器中的仪器b
B. 仪器c在使用时需要先用待取液进行润洗,管尖残留的液体一般不要吹出
C.加入数粒碎瓷片的作用是可以防止液体暴沸
D.上述操作步骤③中在滴定时判断滴定终点的指示剂可以是甲基橙
E.加热回流结束后,要用蒸馏水对冷凝管管壁进行冲洗
(3)在加热回流过程中,可以用水浴作为恒温加热源吗?同时请说明理由。???????
(4)下列因素对测定水样中的COD能产生影响的有??????(用相应编号填写)
①硫酸的用量???????? ②反应装置中的锥形瓶在反应前用蒸馏水洗涤?
③重铬酸钾的用量???? ④回流时间的长短
(5)实验室配制重铬酸钾标准溶液的主要步骤及装置如下所示:

将上述实验步骤A到F按实验过程先后次序排列????????????????????
(6)已知:重铬酸钾标准溶液的c(Cr2O72—)=0.0250mol·L—1,硫酸亚铁铵溶液的c(Fe2+)=0.0100 mol·L—1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为12.00mL,则按上述实验方法,测得的该水样的化学需氧量CODCr(O2)=???????mg/L
本题答案:(1)移液管(2分)???????溶液吸至标线以上(2分)?
本题解析:
试题分析:(1)根据仪器c的构造知,仪器c的名称为:移液管;用仪器c吸取液体时,左手拿洗耳球,右手将仪器c插入溶液中吸取,当溶液吸至标线以上时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即 按紧管口。(2) A、硫酸亚铁铵溶液水解呈酸性,用硫酸亚铁铵溶液滴定时需上述仪器中的仪器a酸式滴定管,错误;B、移液管在使用时需要先用待取液进行润洗,管尖残留的液体一般不要吹出,正确; C、甲基橙的变色范围是3.1——4.4,铁离子转化为沉淀,不能用甲基橙作指示剂,错误; E、加热回流结束后,为使样品全部反应,要用蒸馏水对冷凝管管壁进行冲洗,正确;选AD;(3)在加热回流过程中,不能用水浴作为恒温加热源,理由是水浴温度不超过100。C ,难以使水样回流。(4)根据题给反应和信息知,①硫酸的用量③重铬酸钾的用量④回流时间的长短对测定结果有影响,选①③④;(5)实验室配制重铬酸钾标准溶液的主要步骤是计算、称量、溶解、转移、洗涤、定容、摇匀,结合题给装置知,实验步骤A到F按实验过程先后次序排列CBDFAE;(6)根据反应Cr2O72—+14H++6Fe2+=6Fe3++2Cr3++7H2O知,与硫酸亚铁铵溶液反应的重铬酸根的物质的量n=c(Fe2+)V(Fe2+)/6=0.0100 mol·L—1×0.012L÷6=2×10—5mol,则与20mL水样反应的重铬酸根的物质的量n=2.5×10—4mol —2×10—5mol =2.3×10—4mol,根据电子守恒知,转化成氧气的物质的量为3.45×10—4mol,则按上述实验方法,测得的该水样的化学需氧量CODCr(O2)=552mg/L。
本题所属考点:【物质组成与性质实验方案的设计】
本题难易程度:【一般】
A wise man cares not for what he cannot have. 智者不为自己得不到的东西而烦恼.