微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称摩尔盐。某兴趣小组制备硫酸亚铁铵的实验方案示意图如下:
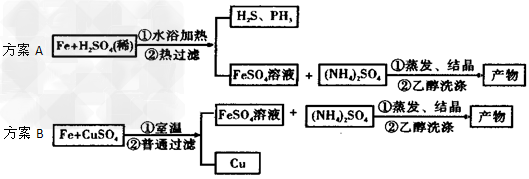
已知:H2S、PH3为有毒气体,都能被CuSO4溶液吸收除去。请回答下列问题:?
(1)实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑。从以下仪器中选择组装,完成该操作必需的仪器有________?(填编号)。
①铁架台????②玻璃棒????③广口瓶????④石棉网????⑤烧杯????⑥漏斗??⑦酒精灯
(2)方案A中FeSO4溶液的制备:将处理好的铁屑放入锥形瓶,加入过量的3?mol/LH2SO4溶液,加热至充分反应为止。趁热过滤,收集滤液和洗涤液。下右图装置中方框内选择更适合用于实验方案A的装置是__________??(填“甲”或“乙”)。
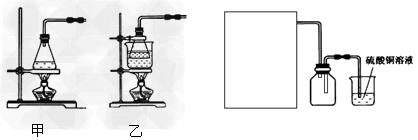
(3)方案A中废铁屑中含氧化铁,无需在制备前除去,理由是__________________(用离子方程式回答),用无水乙醇洗涤晶体的原因是___________________。
(4)实验方案B中FeSO4溶液的制备:用“五水硫酸铜结晶水的测定”实验中的废弃物--无水硫酸铜粉末代替稀硫酸与铁屑反应制备硫酸亚铁。当用无水硫酸铜配制的溶液由蓝色完全变为浅绿色时停止反应,过滤,收集滤液即得硫酸亚铁溶液。此方案的优点有_________??(填编号)。
a.?充分利用了实验室废弃物--硫酸铜粉末,避免了药品浪费,又回收了金属铜,实现了变废为宝
b.?避免了有毒气体的排放对环境造成的污染
c.?原子利用率达到100%
d.?避免了在加热中Fe2+被氧化成Fe3+,?有利于产品质量等级的提高,并节约了能源
(5)产品中Fe3+杂质的定量分析
①配制Fe3+浓度为1.0mg/mL的标准溶液100mL。称取_________mg高纯度的硫酸铁铵(NH4)Fe(SO4)2·12H2O,加?2.00?mL经处理的去离子水,振荡溶解后,加入2 mol/L?HBr?溶液?l?m?L和?l?mol/L?KSCN溶液0.5?mL,加水制成100?mL溶液。配制过程中必须用到的定量仪器为________(选填编号)。
a.?精确度为0.001g的电子天平??????????????
b.精确度为0.1mg的电子天平???
c.100?mL容量瓶?????????
d.酸式滴定管?????
e.10mL量筒
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液。分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。
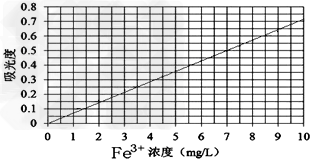
③取该兴趣小组所得的硫酸亚铁铵产品,按步骤①配得产品溶液10mL,稀释至100?mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.490、0.510,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_________mg/L。
实验题 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称摩尔盐。某兴趣小组制备硫酸亚铁铵的实验方案示意图如下:

已知:H2S、PH3为有毒气体,都能被CuSO4溶液吸收除去。请回答下列问题:?
(1)实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑。从以下仪器中选择组装,完成该操作必需的仪器有________?(填编号)。
①铁架台????②玻璃棒????③广口瓶????④石棉网????⑤烧杯????⑥漏斗??⑦酒精灯
(2)方案A中FeSO4溶液的制备:将处理好的铁屑放入锥形瓶,加入过量的3?mol/LH2SO4溶液,加热至充分反应为止。趁热过滤,收集滤液和洗涤液。下右图装置中方框内选择更适合用于实验方案A的装置是__________??(填“甲”或“乙”)。

(3)方案A中废铁屑中含氧化铁,无需在制备前除去,理由是__________________(用离子方程式回答),用无水乙醇洗涤晶体的原因是___________________。
(4)实验方案B中FeSO4溶液的制备:用“五水硫酸铜结晶水的测定”实验中的废弃物--无水硫酸铜粉末代替稀硫酸与铁屑反应制备硫酸亚铁。当用无水硫酸铜配制的溶液由蓝色完全变为浅绿色时停止反应,过滤,收集滤液即得硫酸亚铁溶液。此方案的优点有_________??(填编号)。
a.?充分利用了实验室废弃物--硫酸铜粉末,避免了药品浪费,又回收了金属铜,实现了变废为宝
b.?避免了有毒气体的排放对环境造成的污染
c.?原子利用率达到100%
d.?避免了在加热中Fe2+被氧化成Fe3+,?有利于产品质量等级的提高,并节约了能源
(5)产品中Fe3+杂质的定量分析
①配制Fe3+浓度为1.0mg/mL的标准溶液100mL。称取_________mg高纯度的硫酸铁铵(NH4)Fe(SO4)2·12H2O,加?2.00?mL经处理的去离子水,振荡溶解后,加入2mol/L?HBr?溶液?l?m?L和?l?mol/L?KSCN溶液0.5?mL,加水制成100?mL溶液。配制过程中必须用到的定量仪器为________(选填编号)。
a.?精确度为0.001g的电子天平??????????????
b.精确度为0.1mg的电子天平???
c.100?mL容量瓶?????????
d.酸式滴定管?????
e.10mL量筒
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液。分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。

③取该兴趣小组所得的硫酸亚铁铵产品,按步骤①配得产品溶液10mL,稀释至100?mL,然后按步骤②的方法进行测定,两 次测定所得的吸光度分别为0.490、0.510,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_________mg/L。
本题答案:(1)①②④⑤⑦
(2)乙
(3)Fe2O3?+
本题解析:
本题所属考点:【物质制备实验方案的设计】
本题难易程度:【一般】
It is easy to swim if another holds up your head. 有人扶着头,容易学游泳.