微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一块金属钠分别投入到下列物质中,有气体放出且溶液质量减轻的是
A.CuSO4溶液
B.稀盐酸
C.NaCI溶液
D.蒸馏水
参考答案:A
本题解析:A 钠投入到CuSO4溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应,生成氢氧化铜沉淀,溶液质量减轻,且有气体放出。
B钠投入到稀盐酸中,有气体放出且溶液质量增加
C 钠投入到NaCI溶液,钠只跟水反应,生成氢氧化钠和氢气,有气体放出且溶液质量增加
D钠投入到蒸馏水中 ,钠只跟水反应,生成氢氧化钠和氢气,有气体放出且溶液质量增加
故应该选A
本题难度:一般
2、选择题 能够用于鉴别二氧化硫和二氧化碳的溶液是
A.澄清的石灰水
B.品红溶液
C.紫色石蕊试液
D.BaCl2溶液
参考答案:B
本题解析:试题分析:二氧化硫和二氧化碳都能使澄清的石灰水变混浊,A不正确;二氧化硫可以使品红溶液褪色,但二氧化碳不能,B正确;二者溶于水溶液都显酸性,都可以使紫色的石蕊试液变红色,C不正确;二者和氯化钡溶液都不反应,D不正确,答案选B。
考点:考查二氧化硫和二氧化碳的鉴别
点评:该题是中等难度的试题,也是高考中的常见考点,试题基础性强,难易适中,有助于培养学生的严谨的实验分析以及探究能力。该题的关键是熟练记住二者的性质差异,然后结合题意具体问题、具体分析即可。
本题难度:困难
3、选择题 甲试管中盛有0.5mol/L?Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴加0.5mol/L?Na2CO3溶液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为
A.甲=乙
B.甲>乙
C.甲<乙
D.无法确定
参考答案:C
本题解析:由于碳酸钠和盐酸的反应是分步进行的,即方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。所以根据方程式可知,乙中生成的CO2多,答案选C。
本题难度:困难
4、选择题 现有FeO和Fe2O3组成的混合物ag,向其中加入2mol/L的硫酸溶液100mL,恰好完全反应;若将ag该混合物与足量的铝热反应,冷却后最终可得铁的质量为
A.3.2ag
B.3.2+a?g
C.(a-3.2)g
D.(a-6.4)g
参考答案:C
本题解析:分析:FeO和Fe2O3组成的混合物与硫酸反应生成硫酸盐和水,氧离子为-2价,硫酸根为-2价,可知FeO和Fe2O3组成的混合物中氧原子的物质的量等于硫酸的物质的量,即n(O)=n(H2SO4),FeO和Fe2O3组成的混合物质量减去氧的质量即为金属铁的质量.
解答:n(H2SO4)=0.01L×2mol/L=0.02mol,
所以FeO和Fe2O3组成的混合物中O的质量为0.02mol×16g/mol=0.32g,
若将ag该混合物与足量的铝热反应,使其充分反应,终可得铁的质量为ag-0.32g=(a-0.32)g.
故选:C.
点评:本题考查混合物的计算,题目难度中等,本题根据氧离子与硫酸根硫酸根的化合价,利用等量代换法,得出硫酸的物质的量与金属氧化物中O元素的物质的量相等,此为解答该题的关键,也可以金属氧化物与硫酸反应的关系式确定.
本题难度:一般
5、选择题 称取两份铝粉,第一份加入足量的浓NaOH(aq),第二份加入足量的HCl(aq),如果放出的气体体积为1:3(在同温同压下),则两份铝粉的质量之比为
A.1:2
B.1:3
C.3:2
D.1:1
参考答案:B
本题解析:分析:因酸、碱足量,则铝完全反应,由电子守恒来计算Al的物质的量,铝的物质的量之比等于质量之比.
解答:放出的气体体积为1:3,设生成的氢气的物质的量分别为1mol、3mol,
设第一份中的Al的物质的量为x,第二份中的Al的物质的量为y,
因酸、碱足量,则铝完全反应,
由电子守恒可知,
x×3=1mol×2×(1-0),
y×3=3mol×2×(1-0),
解得x=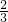 mol,y=2mol,
mol,y=2mol,
则两份铝粉的质量之比为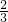 mol:2mol=1:3,
mol:2mol=1:3,
故选B.
点评:本题考查铝与酸、碱的反应,明确酸碱足量及反应均为氧化还原反应,利用电子守恒来计算是解答的关键.
本题难度:困难