微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学用语表示正确的是(??)
A.乙炔的电子式: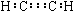
B.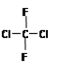 和
和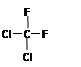 是同一物质
是同一物质
C.对甲基苯甲醇的结构简式:
D.乙醇分子的比例模型: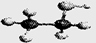
参考答案:B
本题解析:
试题分析:乙炔分子中,每个碳原子提供3个电子,A错;C为对甲基苯酚,命名错;D为球棍模型。
本题难度:一般
2、选择题 现将金属镁和铝的混合物7.5g完全溶解于一定浓度足量的硝酸溶液中,收集反应产生的A 气体。向所得溶液中加入过量烧碱溶液,得到沉淀11.6 g。则气体A的成分可能是
A.0.2mol NO和0.1mol NO2
B.0.3 mol NO
C.0.1mol NO、0.2mol NO2和0.1mol N2O4
D.0.3 mol NO2和0.1mol N2O4
参考答案:AC
本题解析:
试题分析:金属镁和铝的混合物与一定浓度足量的硝酸溶液发生反应,形成Mg2+、Al3+,向所得溶液中加入过量的NaOH 溶液,也有Al(OH)3是两性物质,可以与强碱溶液发生反应形成可溶性物质,所以形成沉淀Mg(OH)2,n(Mg(OH)2)= 11.6 g÷58g/mol=0.2mol,则7.5g金属中含有Mg的质量是0.2mol× 24g/mol=4.8g,含有Al质量是2.7g.Al的物质的量是0.1mol。则金属失去电子的物质的量是0.2mol×2 +0.1mol×3=0.7mol。假设反应形成的NO的物质的量是x,形成NO2的物质的量是y,则硝酸转化为气体得到电子的物质的量也应该是0.7mol.A.0.2mol NO和0.1mol NO2得到电子的物质的量是0.2mol×3+ 0.1mol×1=0.7mol,正确;B.0.3 mol NO,得到电子的物质的量是0.3 mol×3=0.9mol>0.7mol,电子转移不守恒,正确;C.形成0.1mol NO、0.2mol NO2和0.1mol N2O4气体,得到电子的物质的量是:0.1mol ×3+ 0.2mol×1+0.1mol×2=0.7mol,正确;D.形成0.3 mol NO2和0.1mol N2O4,硝酸得到电子的物质的量是0.3 mol×1+0.1mol×2=0.5mol<0.7mol,错误。
考点:考查守恒方法在氧化还原反应的计算中的应用的知识。
本题难度:一般
3、选择题 正确掌握化学用语和化学基本概念是学好化学的基础。下列各项中表达正确的是
A.NaCl的电子式: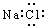
B.H2O分子的分子结构模型示意图: (三个原子在同一直线上)
(三个原子在同一直线上)
C.CrO5的结构式为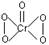 ,该氧化物中Cr为+6价
,该氧化物中Cr为+6价
D.次氯酸的结构式:H-Cl-O
参考答案:C
本题解析:
试题分析:选项A、错误。氯化钠是一种离子晶体,其化学键为离子键,而不是共价键;
选项B、水分子的三个原子不在同一条直线上;
选项D、次氯酸的结构式应为:H-O-Cl;
点评:本题是对化学用语的考查,属于基础性的题目。
本题难度:简单
4、选择题 下列有关氧化还原反应的叙述中,正确的是
A.一定有氧气参加
B.还原剂本身被还原
C.氧化反应先于还原反应发生
D.一定有电子转移(得失或偏移)
参考答案:D
本题解析:
试题分析:氧化还原反应的特征是化合价的升降,实质是单质转移。氧化剂得到电子,化合价降低,本身被还原;还原剂失去电子,化合价升高,本身被氧化,氧化反应和还原反应是同时进行的。
本题难度:简单
5、选择题 绿柱石又称绿宝石,其主要成分为BenAl2[Si6O18],也可以用二氧化硅和金属氧化物的形式表示,(已知Be在化合物中一般为+2价),n为
A.1
B.2
C.3
D.4
参考答案:C
本题解析:
试题分析:根据化合价代数和为零原则,求算n,Be为+2价,Al为+3价,Si为+4价,O为-2价,则18×2=2n+2×3+4×6,求出n=3。
点评:本题也可以用氧化物改写来求,但是根本依据还是化合价代数和为零,属于简单题。
本题难度:简单