微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室欲使1.6 g Fe2O3完全被还原,事先应准备CO气体(在标准状况下)的体积为 [???? ]
A.672 mL
B.336 mL
C.大于672 mL
D.小于336 mL
参考答案:C
本题解析:
本题难度:一般
2、选择题 一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是
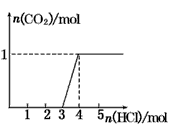
[???? ]???
A.通入的CO2气体在标准状况下可能大于22.4 L
B.A溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
参考答案:B
本题解析:
本题难度:一般
3、选择题 往含有0.2?mol?KOH和0.1?mol?Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72?L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解忽略不计)[???? ]
A.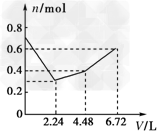
B.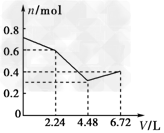
C.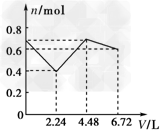
D.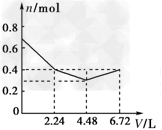
参考答案:D
本题解析:
本题难度:一般
4、计算题 黄金的纯度以K为单位来表示,24K的黄金是纯金,12K的黄金含50%的金,其余是银和铜。
(1)18K的黄金含金多少?
(2)为什么经常用掺入其他金属的黄金做首饰?
(3)请你尝试找出合金比纯金属更有用的两种性质,并举例 说明。
参考答案:(1)75%。
(2)制成合金,使其熔点低,硬度大,易
本题解析:
本题难度:一般
5、选择题 已知Fe3O4可表示成(FeO?Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.每生成1molFe3O4,则转移电子数为2mol
C.参加反应的氧化剂与还原剂的物质的最之比为1:1
D.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
参考答案:D
本题解析:分析:A、所含元素化合价降低得到反应物是氧化剂,所含元素化合价升高的反应物是还原剂.结合方程式中元素化合价变化判断.
B、反应中只有氧气中氧元素的化合价降低,由0价升高为-2价,据此计算转移电子物质的量.
C、所含元素化合价降低得到反应物是氧化剂,所含元素化合价升高的反应物是还原剂.结合方程式计算判断.
D、根据部分电子转移守恒计算.
解答:在3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+ ;硫元素的化合价变化为:+2→
;硫元素的化合价变化为:+2→ +;氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-.
+;氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-.
A、由上述分析可知,还原剂是Fe2+、S2O32-,氧化剂是O2,故A错误;
B、由方程式可知,每生成1molFe3O4,参加反应的氧气为1mol,转移电子数为1mol×4=4mol,故B错误;
C、由上述分析可知,氧化剂是O2,还原剂是Fe2+、S2O32-,3molFe2+参加反应时只有2mol被氧化,参加反应的氧化剂与还原剂的物质的最之比为1:(2+2)=1:4,故C错误;
D、2molFe2+被氧化时,失去电子2mol,则被Fe2+还原的O2的物质的量为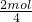 =0.5mol,故D正确.
=0.5mol,故D正确.
故选:D.
点评:考查氧化还原反应的基本概念与计算,Fe3O4是复杂的化合物,铁元素既有+2价也有+3价,把Fe3O4中铁元素的化合价用平均化合价处理,S2O32-的硫元素的化合价用平均化合价处理是解本题的关键,本题难度较大,需细心分析.
本题难度:一般