微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数,钠的摩尔质量为M?g/mol,钠的密度为ρg/cm3,则以下说法中,正确的是
①1g?Na所含原子数为ρNA个???????? ②1cm3Na所含原子数为ρNA/M个???? ③1个钠原子的质量为M/NAg??
④1个钠原子占的体积为M/ρNAcm3??? ⑤1g钠在足量O2中燃烧失去的电子数为2NA/M个.
A.①②③
B.②③④
C.①②④
D.③④⑤
参考答案:B
本题解析:分析:①钠为金属晶体,求1g?Na所含原子数,根据公式求出1g?Na的物质的量即可;
②根据密度公式求出1cm3Na的质量,再根据公式n= 求解;
求解;
③钠的摩尔质量为M?g/mol,1mol钠的质量为Mg,1mol钠含有NA个钠原子;
④钠的密度为ρg/cm3,根据②求出1cm3Na所含原子数为ρNA/M个,即可求出1个钠原子占的体积;
⑤钠在足量O2中燃烧生成过氧化钠.
解答:①钠的摩尔质量为M?g/mol,根据公式n= =
=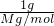 ,所含原子数为
,所含原子数为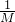 NA个,故①错误;
NA个,故①错误;
②根据公式,1cm3Na质量为m=ρ×V=ρg/cm3×1cm3=ρg,ρg?Na的物质的量为 =
=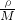 mol,所含原子数为ρNA/M个,故②正确;
mol,所含原子数为ρNA/M个,故②正确;
③1mol钠的质量为Mg,1mol钠含有NA个钠原子,1个钠原子的质量为M/NAg,故③正确;
④根据②可知1cm3Na所含原子数为 个,设1个钠原子占的体积为V,则
个,设1个钠原子占的体积为V,则 个钠原子的体积为
个钠原子的体积为 ×V=1cm3,则1个钠原子占的体积V=
×V=1cm3,则1个钠原子占的体积V= cm3.故④正确;
cm3.故④正确;
⑤钠原子最外层只有1个电子,钠在足量O2中燃烧反应2Na+O2 Na2O2,1mol钠在该反应中失去1mol电子,1g钠的物质的量为
Na2O2,1mol钠在该反应中失去1mol电子,1g钠的物质的量为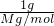 =
=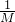 mol,在足量O2中燃烧失去的电子数为
mol,在足量O2中燃烧失去的电子数为 个,故⑤错误;
个,故⑤错误;
故选B.
点评:解答该题的关键在于能熟练地运用与物质的量相关的计算公式,平时应注意理清它们间的关系.
本题难度:简单
2、选择题 体积相同的NaCl、MgCl2、AlCl3溶液,沉淀其中的Cl-,消耗等量的AgNO3,三种溶液的物质的量浓度之比为
A.3:2:1
B.1:2:3
C.6:3:2
D.2:3:6
参考答案:C
本题解析:分析:根据消耗等物质的量的AgNO3,可知NaCl、MgCl2、AlCl3三种溶液中含氯离子的物质的量相同,根据化学式计算物质的量,进而计算物质的量浓度之比.
解答:分别加入足量的硝酸银溶液,Cl-沉淀完全时,消耗等物质的量的AgNO3,可知NaCl、MgCl2、AlCl3三种溶液中含氯离子的物质的量相同,
假设n(Cl-)=1mol,根据物质的化学式可知:
n(NaCl)=1mol,
n(MgCl2)= mol,
mol,
n(AlCl3)= mol,
mol,
溶液的体积相同,则物质的量之比等于物质的量浓度之比,
所以,三种溶液的物质的量浓度之比为:c(NaCl):c(MgCl2):c(AlCl3)=1: :
: =6:3:2,
=6:3:2,
故选C.
点评:本题考查物质的有关计算,题目难度不大,本题注意把握物质的量与质量、浓度等物理量的计算公式的运用.
本题难度:一般
3、选择题 用NA代表阿伏加德罗常数值.下列说法正确的是
A.2.3g钠在空气中加热反应时,失去的电子数为0.2NA
B.标准状况下,1.12L的HCHO所含的原子数为0.2NA
C.28g?C2H4和C4H8混合物中所含的分子数为3NA
D.1mol?FeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒
参考答案:B
本题解析:分析:A、质量换算物质的量,计算失去电子数,钠加热反应生成过氧化钠;
B、根据气体摩尔体积的条件应用计算判断;
C、依据质量和摩尔质量换算物质的量计算分子数;
D、胶体微粒是氢氧化铁的集合体;
解答:A、2.3g钠物质的量为0.1mol,完全反应转移电子数为0.1NA,故A错误;
B、标准状况下,甲醛是气体,1.12L的HCHO物质的量为0.05mol,含原子数为0.05mol×4×NA=0.2NA,故B正确;
C、28g C2H4和C4H8混合物中含分子数,若全是C2H4分子数= ×NA=NA,若全是C4H8分子数=
×NA=NA,若全是C4H8分子数= =0.5mol,所以28g C2H4和C4H8混合物中含分子数在0.5NA-NA间,故C错误;
=0.5mol,所以28g C2H4和C4H8混合物中含分子数在0.5NA-NA间,故C错误;
D、Fe(OH)3胶粒是氢氧化铁的微粒集合体,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,质量换算物质的量计算微粒数,气体摩尔体积的条件应用,胶体微粒的组成,熟练掌握概念和计算,即可解决.
本题难度:简单
4、选择题 同温同压下,等质量的SO2气体和SO3气体相比较,下列叙述中正确的是
A.密度比为4:5
B.物质的量之比为4:5
C.体积比为1:1
D.原子数之比为3:4
参考答案:A
本题解析:分析:根据质量计算气体的物质的量,可得物质的量之比,根据分子组成可得原子数之比,同温同压下,气体的物质的量之比等于体积之比,密度之比等于相对分子质量之比.
解答:A、由n=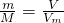 可知,
可知, ,在相同条件下气体的相对分子质量之比等于密度之比,
,在相同条件下气体的相对分子质量之比等于密度之比,
所以两种气体的密度之比为:64:80=4:5,故A正确;
B、设气体的质量为m,则n(SO2)= mol,n(SO3)=
mol,n(SO3)=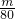 mol,所以物质的量之比为=
mol,所以物质的量之比为= :
: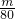 =80:64=5:4,故B错误;
=80:64=5:4,故B错误;
C、根据V=n?Vm可知,同温同压下,气体的物质的量之比等于体积之比,所以两种气体体积之比等于5:4,故C错误;
D、根据分子组成可知,两种气体的原子数之比为:5×3:4×4=15:16,故D错误.
故选A.
点评:本题考查阿伏加德罗定律及推论,题目难度中等,注意物质的量与体积、密度、原子数目的计算公式的运用.
本题难度:困难
5、选择题 下列叙述正确的是
A.1molCO2的质量为44g?mol-1
B.固体或液体物质的体积主要决定于微粒个数及微粒之间的平均距离
C.SO42-的摩尔质量为96g
D.O2的摩尔质量为32g?mol-1
参考答案:D
本题解析:分析:A、质量的单位是g.
B、固体和液体物质的体积主要决定于微粒个数和粒子的大小.
C、摩尔质量的单位是g/mol.
D、氧气分子的摩尔质量在数值等于其相对分子质量.
解答:A、1mol二氧化碳的质量为44g,故A错误.
B、固体和液体中粒子之间的距离是非常小的,所以固体和液体物质的体积主要决定于微粒个数和粒子的大小,故B错误.
C、SO42-的摩尔质量为96g/mol,故C错误.
D、氧气分子的摩尔质量在数值等于其相对分子质量,即为32g?mol-1,故D正确.
故选D.
点评:本题考查了基本概念和基本理论,难度不大,注意基础知识的积累.
本题难度:困难