微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 100mL0.3mol·L-1Na2SO4溶液和50mL0.2mol·L-1Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度(设体积为二者之和)为( )
A.0.2mol?L-1 B.0.25 mol?L-1 C.0.4 mol?L-1 D、0.5 mol?L-1
参考答案:C
本题解析:
试题分析:n(SO42-)=0.1×0.3mo·L-1+0.05L×3×0.2mol·L-1=0.06mol.C(SO42-)="n/V=0.06mol/0.15L=0.4" mol/L.选项为:C
考点:考查混合溶液中微粒的物质的量浓度的计算的知识。
本题难度:一般
2、选择题 已知质量分数为98%的浓硫酸的物质的量浓度为18.4 mol·L-1,则物质的量浓度为9.2 mol·L-1的硫酸溶液的质量分数为(????)
A.49%
B.小于49%
C.大于49%
D.无法确定
参考答案:C
本题解析:假设原溶液的密度及质量分类分别为:ρ1g/mL、a1%,所得溶液的密度及质量分数分别为ρ2g/mL、a2%,由公式: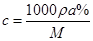 ,可知:
,可知: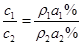 本题难度:一般
本题难度:一般
3、选择题 设NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol氦气中有2NA个氦原子
B.18 g水中所含的电子数为10NA
C.0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+
D.11.2L氮气中含NA个氮原子
参考答案:B
本题解析:
试题分析:氦气是氮原子分子,所以1 mol氦气中有NA个氦原子。一个水分子含有10个电子,18 g水是1mol,所以含电子数为10NA。0.3 mol·L-1Na2SO4溶液不知道体积,不能确定其物质的量。11.2L氮气中含NA个氮原子,不在标准状况下不能确定物质的量。答案选B。
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,
本题难度:一般
4、填空题 (2分)常温常压下CO与H2等体积混合总质量为15g,则混合气体中H2的质量是?????????g。
参考答案:(2分)1g
本题解析:
试题分析:设氢气和CO的物质的量都是x,则根据n=m/M可知,28g/mol×x+2g/mol×x=15g,解得x=0.5mol。所以氢气的质量是2g/mol×0.5mol=1g。
点评:该题关键是根据阿伏加德罗定律得出氢气和CO的物质的量相等,然后依据条件列式计算即可。
本题难度:一般
5、选择题 NA为阿伏加德罗常数,下列叙述正确的是
A.10 g H218O含有的中子数为5NA
B.1 mol羟基(-OH)含有的电子数为10NA
C.1 mol 氯气参加反应时,电子转移数目一定为2NA
D.标准状况下,11.2L己烷含有的分子数为0.5 NA
参考答案:A
本题解析:
试题分析:A.H218O的相对分子质量是20.每个分子中含有10个中子。10 g H218O的物质的量为0.5mol,所以含有的中子数是5NA。正确。B.羟基(-OH)含有的电子是 9个,所以1 mol羟基(-OH)含有的电子数为9NA.错误。C.如:在Cl2+2NaOH=NaCl+NaClO中,每摩尔氯气反应转移电子1摩尔即NA。所以错误。D.标准状况下,己烷是液态,含有的分子数大于0.5 NA。错误。
本题难度:一般