微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白剂和杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
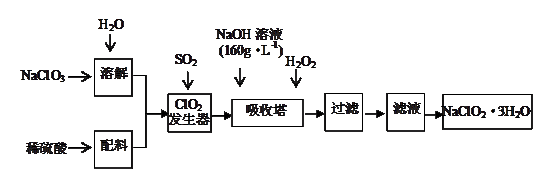
已知:NaOH溶液(160g·L-1)是指每升溶液中含溶质160 g。
试回答下列问题:
(1)该NaOH溶液的物质的量浓度为???????????。
(2)在吸收塔中,ClO2、NaOH与H2O2反应生成NaClO2和O2,则该反应中还原剂与氧化剂的物质的量之比为?????????。
(3)NaClO2较稳定,但其固体在加热时或敲击时会立即发生爆炸,其爆炸后的产物可能是
?????????(填字母)
A.NaCl、Cl2
B.NaCl、NaClO
C.NaClO3、NaClO4
D.NaCl、NaClO3
(4)NaClO3与SO2反应生成ClO2,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:?????????????????????????????????????????????????????????????????。
参考答案:(1)4mol/L ------2分??(2)1:2----
本题解析:(1)NaOH溶液是160g·L-1,所以物质的量浓度是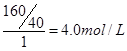 。
。
(2)氯元素的化合价从+4价降低到+3价,氧元素的化合价从-1价升高到0价,所以氧化剂ClO2和还原剂H2O2的物质的量之比是2︰1。
(3)根据题意可知,氯元素的化合价既升高,还降低,所以选项D正确。
(4)氯元素的化合价从+5价降
本题难度:一般
2、填空题 某厂废水中含5.00×10-3mol·L-1的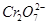 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
( 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
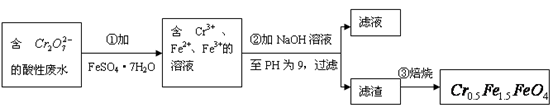
(1)第①步反应的离子方程式是?????????????????????????????????????????????????
(2)第②步中用PH试纸测定溶液PH的操作是:
??????????????????????????????????????????????????????????????????????????????
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有??????????????????????
(4)欲使1L该废水中的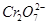 完全转化为
完全转化为 。理论上需要加入??????????
。理论上需要加入??????????
GFeSO4·7H2O。
参考答案:
(1)Cr2O72- + 6Fe2+ + 14H+<
本题解析:(1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;
(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;
(4)1L废水中的n( 本题难度:一般
本题难度:一般
3、选择题 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与浓硝酸②Fe与浓硫酸③Na与氧气④P2O5与水,由于反应温度不同而能发生不同氧化还原反应的是(??? )
A.②③④
B.②③
C.①②③
D.③④
参考答案:B
本题解析:Cu与浓硝酸反应不论温度高低都生成Cu(NO3)2、NO2、H2O,而Fe与浓硫酸在低温下发生钝化,温度高会发生反应,生成Fe2(SO4)3、SO2、H2O;Na与氧气在高温下生成Na2O2,低温下生成Na2O;P2O5与水反应化合价没有发生变化,不属于氧化还原反应。
本题难度:简单
4、填空题 (6分)某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(要求配平)?????????????。
(2)反应中,被还原的物质是????????,Cr2(SO4)3是?????????????。
(3)在酸性条件下K2Cr2O7与草酸(H2C2o4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为????????。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
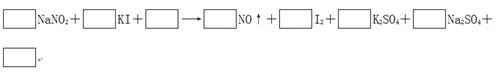
5、填空题 由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下:
 ?
?
(1)请完成并配平该化学方程式。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
________________________________________________________________________。
从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)根据方程式可知,碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,做还原剂。亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,做氧化剂。则根据电子守恒可知氧化剂和和还原剂的物质的量之比时1:1。根据原子守恒可知,反应物中还有硫酸生成,生成物还有水生成,则反应的化学方程式是2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O。
(2)50.8g单质碘的物质的量是50.8g÷254g/mol=0.2mol,所以转移电子的物质的量是
本题难度:一般