微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 【化学——选修2:化学与技术】(15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有???、??。
(2)天然水在净化处理过程中加入的混凝剂可以是????,其净水作用的原理是????。
(3)水的净化和软化的区别是???????。
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.2×10—3mol/L,c(Mg2+)=6×10—4mol/L,则此水的硬度为???。
(5)若(4)中的天然水还含有c(HCO3—)=8×10—4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2???g,后加入Na2CO3???g。
参考答案: 本题解析:略
本题解析:略
本题难度:一般
2、填空题 冶炼金属的三种常用方法是:①热分解法??②热还原法??③电解法。(填序号)
(1)冶炼铝用到的方法是????????;
(2)冶炼铁的常用方法是????????。
参考答案:(1)③(1分);??(2)②(1分)
本题解析:
试题分析:金属的冶炼一般是依据金属的活泼性选择相应的方法,常见金属冶炼的方法有:1.热分解法:适用于不活泼的金属,如汞可用氧化汞加热制得;2.热还原法:用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原;3.电解法:适用于K、Ca、Na、Mg、Al等活泼金属;4.其他方法:如CuSO4+Fe=Cu+FeSO4。由此可判断。
(1)铝是活泼的金属,冶炼铝用到的方法是电解法,答案选③;
(2)Fe是较活泼的金属,冶炼铁的常用方法是热还原法,答案选②。
本题难度:简单
3、填空题 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
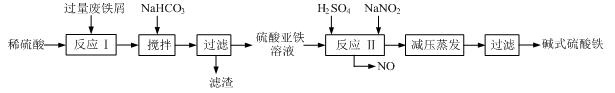
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
?
回答下列问题:
(1)加入过量废铁屑的目的是?????????????????????????,此时溶液中存在的阳离子主要有????????????????,用NaHCO3调整溶液pH时的离子方程式是??????????????????。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,同时通入O2的作用是???????????????????????????????????。
(3)碱式硫酸铁溶于水后能电离产生[Fe(OH)]2+离子,写出[Fe(OH)]2+发生水解反应生成Fe(OH)3的离子方程式??????????????????????????????????????????。
(4)已知废铁屑中铁元素的质量分数为84.0%,若不考虑每步反应中铁元素的损耗,现有100吨废铁屑理论上最多能生产?????????????吨碱式硫酸铁。
参考答案:(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化
本题解析:
试题分析:(1)把废铁屑加入稀硫酸中,所以其作用为:使硫酸充分反应掉或提高硫酸利用率或使Fe3+尽可能转化为Fe2+;废铁屑还含有Al2O3,所以与H2SO4反应后的溶液含Fe2 +、Al3+;加入NaHCO3后与Al3+发生相互促进的水解反应:3HCO3-+Al3+ =3CO2↑ + Al(OH)3↓。
(2)NaNO2氧化Fe2+会生成NO,造成污染,而O2氧化Fe2+产物无污染,所以O2的作用为:作氧化剂并且可减少污染性气体的排放。
(3)[Fe(OH)]2+结合H2O电离的OH
本题难度:困难
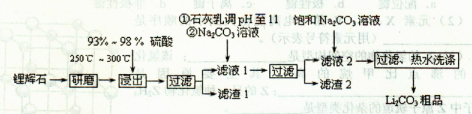
4、选择题 【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:?
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓)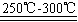 Li2SO4+Al2O3·H2O↓ Li2SO4+Al2O3·H2O↓
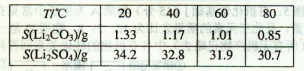
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。
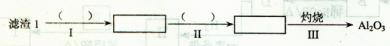
则步骤I中反应的离子方程式是????????????????????????????,步骤Ⅱ应通入一种气体试剂为???????,步骤II反应完之后需要的操作是???????????。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液l中加入石灰乳的作用是(用离子方程式表示)????????????????。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是??????????。
(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是????????????????。
②b中,生成Li2CO3反应的化学方程式是???????????。
参考答案:(1)Al2O3 +6H+ = 2Al3++3H2O(2分)
本题解析:本题考查元素化合物的性质及化学与技术有关知识。(1)用酸将Al2O3溶液解,再通入氨气转化为Al(OH)3沉淀,过滤后灼烧得到Al2O3,步骤I中反应的离子方程式是Al2O3 +6H+ = 2Al3++3H2O,通入的气体物质是NH3,步骤II反应完之后需要的操作是过滤。(2)向滤液l中加入石灰乳的作用是调节溶液的pH值并将Mg2+转化为难溶的Mg(OH)2沉淀,反应的离子方程式为Ca(OH)2 + 2H+ = Ca2+ + 2H2O,Ca(OH)2(s) + Mg2+ 本题难度:简单 本题难度:简单
5、填空题 (12分)碱式碳酸铜[Cu2(OH)2C03]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:

查阅资料知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
| 开始沉淀pH
| 6.0
| 7.5
| 1,4
| 沉淀完全pH
| 13
| 14
| 3.7
(1)氯酸钠的作用是????????????????;
(2)调节溶液A的pH范围为?????????????,可以选择的试剂是????????????.(填序号)。
a.氨水?????????????????? b.硫酸铜?????????????? c.氢氧化铜??????????? d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是??????????;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是??????????????。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:????????????。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净?????????????????。
参考答案:(1)将Fe2+氧化成Fe3+???(2)3.7~6.0??
本题解析:(1)由于沉淀氢氧化亚铁的pH大于沉淀氢氧化铁的pH,所以应该把亚铁离子氧化生成铁离子,然后再沉淀,所以氯酸钠的作用是将Fe2+氧化成Fe3+。
(2)根据表中数据可知,要沉淀氢氧化铁,而不沉淀氢氧化铜,则溶液的pH应该控制在3.7~6.0之间;由于不能引入杂质,所以选择的试剂是cd。
(3)要控制在60℃左右,且保持恒温,可采用的加热方法应该是水浴加热;如果温度过高,则氢氧化铜会分解生成黑色的氧化铜。
(4)根据反应物和生成物可得出反应的方程式为
2Cu2++3CO32-+2H2
本题难度:一般
|
|