微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于平衡CO2(g) CO2(aq);ΔH=-19.75?kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是[???? ]
CO2(aq);ΔH=-19.75?kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是[???? ]
A.升温增压
B.降温减压
C.升温减压?? ????
D.降温增压
2、选择题 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:
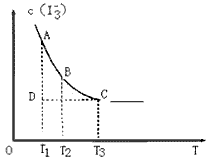
I2(aq)+I-(aq)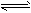 I3-(aq)上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
I3-(aq)上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
 [???? ]
[???? ]
A.该反应的正反应是吸热反应
B.A点与C点的化学反应速率VA<VC
C.在反应进行到D点时, V正>V逆
D.A点与B点相比,B点的c(I2)大
3、选择题 一定条件下,可逆反应N2 +3H2 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
A.加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B.加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C.降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D.增大氮气的浓度,V正增大、V逆 不变,N2 转化率减小,H2转化率增大
4、选择题 N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g)ΔH>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表,下列说法中不正确的是
4NO2(g)+O2(g)ΔH>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表,下列说法中不正确的是
t/s
| 0
| 500
| 1000
| 1500
|
c(N2O5)/(mol·L-1)
| 5.00
| 3.52
| 2.50
| 2.50
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数K1=125
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再次平衡时c(N2O5)>5.00 mol·L-1
5、选择题 一定温度和一定体积的密闭容器中发生如下反应:A2(s)+ B2(g) 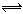 2AB(g) ,反应达到平衡状态的标志是 2AB(g) ,反应达到平衡状态的标志是
A.V正(B2)==2V逆(AB) B.单位时间内生成2molAB的同时消耗1mol的B2
C.容器内的总压强不随时间而变化 D.气体密度不再随时间变化而变化
|