微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用Pt电极电解含有Cu2+和X3+均为0.1 mol的溶液,阴极析出金属的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图,则离子的氧化能力由大到小排列正确的是(?? )
 ????????????
????????????
A.Cu2+>X3+>H+
B.H+>X3+>Cu2+
C.X3+>H+>Cu2+
D.Cu2+>H+>X3+
参考答案:D
本题解析:通电0.2 mol e-后,阴极质量不再增加,恰好Cu2+完全被还原,X3+不能被还原,所以放电顺序依次是Cu2+、H+、X3+。
本题难度:简单
2、选择题 下图是一种以烟道气为原料合成乙醇的工作原理示意图。下列说法正确的是
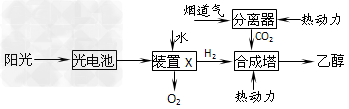 [???? ]
[???? ]
A.该流程图中只存在4种形式的能量转化
B.装置X中阳极反应式为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.本工艺减轻了烟道气中CO2对环境的压力,绿色化学的成分高
参考答案:BD
本题解析:
本题难度:一般
3、选择题 用惰性电极分别电解下列物质的水溶液一段时间后,氢离子浓度不会改变的是[???? ]
A.NaCl
B.CuSO4
C.AgNO3
D.Na2SO4
参考答案:D
本题解析:
本题难度:一般
4、简答题 (15分)海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都可来自于海水。

Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式 。
(2)图甲中流出的b是 溶液。
(3)石棉隔膜的作用是 。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是_______、______________。
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH_ g。
Ⅲ.下图是工业上生产镁的流程。
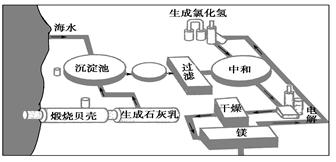
(1)写出下列反应的化学方程式:
①沉淀池: ; ②电解: ;
(2)整个生产流程中循环使用的物质是 。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项: 。
参考答案:Ⅰ.(1)2Cl--2e-=Cl2 ↑
本题解析:
试题分析:Ⅰ.(1)电解饱和NaCl溶液的阳极的反应式是2Cl--2e-=Cl2 ↑;(2)在阴极由于放电能力H+>Na+,所以阴极的电极反应式是:2H++2e-=H2↑.由于破坏了附近的水的电离平衡,使得阴极附近OH-浓度增大,所以图甲中流出的b是NaOH及未电离的NaCl的混合溶液。(3)石棉隔膜的作用是阻止气体通过,防止Cl2与阴极反应反应产物H2、NaOH发生反应。Ⅱ.(1)离子交换膜电解槽中⑥是NaOH溶液;⑦是Na+。(2)n(e-)=(1.929×105 C÷1.602×10-19C)÷6.02×1023=2.0mol。n(NaOH)=2.0mol;m(NaOH)=2.0mol×40g/mol=80g。Ⅲ.(1)由工业上生产镁的流程图可知:①沉淀池的化学反应方程式是MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;②在电解池中的化学反应方程式是MgCl2(熔融)  Mg+Cl2↑。(2)整个生产流程中循环使用的物质是氯气。(3)MgCl2是强酸弱碱盐,在加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的过程中,MgCl2会发生水解反应产生HCl和Mg(OH)2, HCl挥发逸出,最终得到的是Mg(OH)2。所以在加热的过程中要防止其水解。为了防止氯化镁水解,要在氯化氢气体的氛围中加热。最后蒸干得到的就是无水MgCl2。
Mg+Cl2↑。(2)整个生产流程中循环使用的物质是氯气。(3)MgCl2是强酸弱碱盐,在加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的过程中,MgCl2会发生水解反应产生HCl和Mg(OH)2, HCl挥发逸出,最终得到的是Mg(OH)2。所以在加热的过程中要防止其水解。为了防止氯化镁水解,要在氯化氢气体的氛围中加热。最后蒸干得到的就是无水MgCl2。
考点:考查电解原理的应用的知识。
本题难度:困难
5、选择题 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiO(OH)+2H2O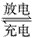 Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是 [???? ]
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是 [???? ]
A.充电时阳极反应:Ni(OH)2-e-+OH-=NiO(OH)+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
参考答案:A
本题解析:
本题难度:一般