微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 金属离子和硫离子在水溶液中的反应比较复杂,其产物与离子的水解、金属硫化物的溶解度、离子氧化性或还原性等因素有关.资料表明,CuS的溶解度很小,在稀酸溶液中也不溶解;Fe2S3的溶解度更小,但却溶于稀酸.下列有关说法正确的是( )
A.Cu2+和S2-在水溶液中反应的产物是CuS
B.NH4+和S2-在水溶液中发生相互促进水解,所以不存在(NH4)2S的水溶液
C.Fe3+和S2-在酸性溶液中反应的产物只可能是Fe2+、S
D.在酸性溶液中,S2-还原Fe3+的能力比还原Cu2+强
参考答案:A.CuS的溶解度很小,在稀酸溶液中也不溶解,Cu2+和S2
本题解析:
本题难度:一般
2、填空题 (12分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 ;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 7N2+12H2O
7N2+12H2O
①上述反应中被还原的元素是 (填元素符号),反应中每转移2.4mol电子,生成N2的物质的量为 。
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3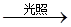 O+O2
O+O2
Ⅱ、NO+O3 →NO2+O2
Ⅲ、 NO2+O→NO+O2
上述反应中NO所起的作用是 ;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ
| 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
|
方法Ⅱ
| 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫
方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,写出该反应的离子方程式: ,是利用了SO2的 性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
参考答案:(1)防止酸雨的发生(2分 其他合理答案同样给分)
本题解析:
试题分析:(1)烟气脱硫、脱硝可以防止酸雨的发生,故答案为:防止酸雨的发生;
(2)①反应中氨气中的N元素由-3价升高为0价,失去电子被还原,由反应可知,转移24mol电子,生成7mol氮气,则反应中每转移2.4mol电子,生成N2的物质的量为0.7mol,故答案为:N;0.7mol;
②将三个反应加和得到总反应为2O3=3O2,则反应中NO所起的作用是催化剂,故答案为:催化剂;
(3)①氨水吸收燃煤烟气中的SO2转化为NH4HSO3,为酸性氧化物与碱的反应,则体现SO2的酸性氧化物性质,方程式为SO2+NH3·H2O=NH4HSO3,故答案为:SO2+NH3·H2O=NH4HSO3;D。
考点:考查氧化还原反应的应用、大气污染治理等
本题难度:一般
3、选择题 根据下列反应判断下列各物质的氧化性由强至弱的顺序正确的是(??)
(1)Ca(ClO)2+4HCl=CaCl2+2Cl2+2H2O?????????? (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2KI=2FeCl2+2KCl+I2
A.Ca(ClO)2>FeCl3>Cl2>I2
B.Cl2> Ca(ClO)2> FeCl3>I2
C.Ca(ClO)2>Cl2>FeCl3>I2
D.Ca(ClO)2>Cl2>I2>FeCl3
参考答案:C
本题解析:在氧化还原反应中,氧化剂的氧化性强于氧化产物的。所以根据反应(1)的方程式可知,氧化性是.Ca(ClO)2>Cl2;依次类推分别是Cl2>FeCl3、FeCl3>I2,所以答案选C。
本题难度:简单
4、填空题 在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液迅速发生反应放出大量气体,反应过程可表示如下:
①H2O2+2KI+H2SO4==I2 +K2SO4+2H2O
②H2O2+ I2 ==2HIO
③H2O2+ 2HIO== I2 +O2↑+2H2O
(1)H2O2在③中的作用是________(填正确选项的编号)。
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
(2)有人认为单质碘是过氧化氢分解的催化剂,这种观点正确吗?为什么? _________。
(3)上述反应说明H2O2、I2 、HIO氧化性从强到弱的顺序是____________。
参考答案:(1)B;
(2)正确;将②+③可得2H2O2
本题解析:
本题难度:一般
5、选择题 根据下列反应:(1)2Fe3++2I-=2Fe2++I2(2)Br2+2Fe2+=2Br-+2Fe3+判断离子的还原性由强到弱的顺序是( )
A.Br->Fe2+>I-
B.I->Fe2+>Br--
C.Br->I->Fe2+
D.Fe2+>I->Br-
参考答案:B
本题解析:根据还原剂的还原性>还原产物的还原性⑴:还原性 I->Fe2+,⑵还原性Fe2+>Br--,B正确。
本题难度:一般
|