微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)随着信息产业的高速发展和家用电器的普及,我国印刷电路板(PCB)的生产呈现急剧增长之势。废旧电路板的增多给我们带来了环境问题,目前我们台州大多采用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜,从而进行对铜的回收和利用。经分析腐蚀废液中主要含有HCl 、FeCl2和CuCl2等溶质。
(1)用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜的原理是
(用离子方程式表示):??? ▲???。
(2)工业上有多种回收腐蚀废液中铜的方法,下面是常用的两种方法:
Ⅰ、电化学方法回收腐蚀废液中铜,则阳极(石墨)上的电极反应式为:?? ▲??。
Ⅱ、工业上也可以用铁粉回收腐蚀废液中的铜:
①用铁粉回收铜的实验操作为????▲????。
②科学家对铁置换铜工艺的研究如下:
分别用还原铁粉、废铁屑和废铁屑在超声波粉碎处理下置换铜,将置换出的铜粉放入250mL烧杯中,加入120mL 1.5 mol·L-1的硫酸,水浴加热,控制温度在70 ℃,搅拌,在10、20、30、40、50、60min时,分别用吸管移取0.5g左右的铜于试管内,将上层清液倒回小烧杯中,用蒸馏水洗净试样,过滤,在105℃烘箱中烘干后测定铜粉中铁的含量。其结果如图所示。
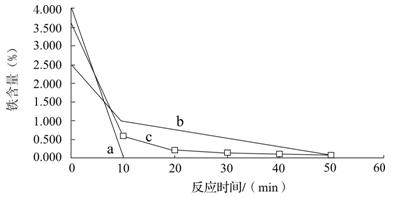
已知a表示用还原铁粉置换铜的除铁效果,b表示用废铁屑置换铜的除铁效果,c表示用废铁屑在超声波下置换铜的除铁效果,你认为除铁效果最好的是??? ▲???(填a、b或c),其原因是??? ▲???。
(3)工业上也可用腐蚀废液生成CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下:
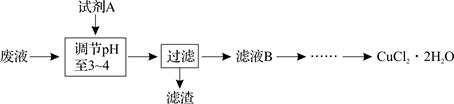
已知:pH ≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH ≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
①试剂A最好应选用??? ▲???。
a.浓硫酸?????? b.Cl2???????c.NaClO d.NaOH溶液
理由是??? ▲???。
②分析有关物质的溶解度曲线(如下图),为了获得CuCl2·2H2O晶体,对滤液B进行的操作是:??? ▲???、??? ▲???,过滤得到产品。
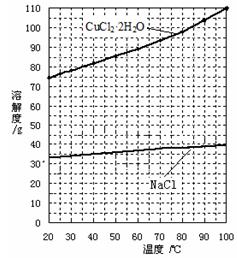
③测定CuCl2·2H2O产品的质量分数可按下法:取2.000g产品,用水溶解后,加入60.00 mL 0.4000 mol·L-1的KI溶液(足量),充分反应后加入淀粉指示剂,用0.4000 mol·L-1 Na2S2O3标准溶液滴定,耗去此标准液25.00 mL时,刚好到达滴定终点。
已知:2Cu2++4I-=2CuI↓+I2??? I2+2S2O32-=2I-+S4O62-
此产品中CuCl2·2H2O的质量分数为??? ▲???。
参考答案:(15分)
(1) 2Fe3++Cu=2Fe2++Cu
本题解析:略
本题难度:简单
2、选择题 常温下,不能用铁制容器存放的物质是
A.浓硫酸
B.浓硝酸
C.CuSO4溶液
D.稀氨水
参考答案:C
本题解析:浓硫酸、浓硝酸都可以使铁制容器发生钝化能用铁制容器存放,A、B不选;
CuSO4+Fe=" Fe" SO4+ Cu????,CuSO4溶液不能用铁制容器存放,稀氨水不与铁反应可用铁制容器存放。答案选C.
本题难度:简单
3、实验题 (14分)Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设
假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究
取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是____________________。
(3)进一步探究
完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
实验步骤
| 预期现象和结论
|
?
| ?
|
?
| ?
参考答案:(14分)(1)红色粉末只含Cu2O (4分)???
本题解析:略
本题难度:一般
4、计算题 大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料。
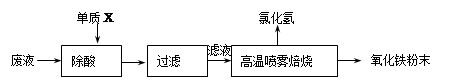
(1)单质X的化学式是???????????????????????。
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末。有关的化学方程式为:
?????????????????????????????????????????????????????
?????????????????????????????????????????????????????
?????????????????????????????????????????????????????
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种。请设计实验探究该铁红涂料中添加的物质。
①提出合理假设
假设1:添加了CuO。???假设2:添加了FeO。
②基于假设????????(填“1”或“2”),设计实验方案,进行实验。在答题卡上写出实验步骤、预期现象和结论。
限选实验试剂:铁粉、3mol?L-1H2SO4、0.01 mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
操作步骤
| 预期现象和结论
| 步骤1.取少量样品于试管中,_________________
____________________________________________
| ?
___________________________
| 步骤2.
____________________________________________
| ?
___________________________
?
(4)用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸。请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸?(写出计算过程,结果可用数学表达式表示,不必化简)。
参考答案:(16分)
(1)Fe????????????????
本题解析:
试题分析:(1)根据除去旧杂质不引入新杂质原则,Fe+2H+=Fe2++H2↑,因此除酸步骤选择的单质X一定是过量的铁粉或铁屑;(2)氯化亚铁是强酸弱碱盐,能水解,且其水解反应是吸热反应,因此高温能使其彻底水解,生成氢氧化亚铁和氯化氢;氯化氢气体逸出,氢氧化亚铁不稳定,容易被空气中的氧气氧化为氢氧化铁;氢氧化铁焙烧时分解,生成氧化铁和水;根据上述三步反应可以得到总反应式;(3)若假设1成立,Fe2O3、CuO都是难溶于水的碱性氧化物,不能直接选择试剂检验CuO的存在,必须先用足量稀硫酸溶解配成硫酸
本题难度:困难
5、实验题 (10分)8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
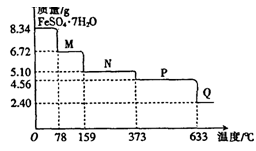
请回答下列问题:
(1)试确定78℃时固体物质M的化学式:?????????????????????????。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式?????????????????????????????????????
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。

①试剂X的名称是???????????????????????????????。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ ?????????????????。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量?????????????????????????????????????(填计算式)?????????????????。
参考答案:
 本题解析: 本题解析:
⑴FeS04·7H20 FeSO4·XH2O+(7-x)H2O FeSO4·XH2O+(7-x)H2O
278??????????????????????? 18(7―X)
8.34??????????????????????? 8.34―6.72
解得X=4
FeS04·4H20
⑵2FeSO4![]()
本题难度:一般
|
|