下层液体从分液漏斗下管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
?
参考答案:B
本题解析:
试题分析:A、烧杯的最大盛液量不超过其容积的1/2,错误;B、排除碱式滴定管中气泡的操作,正确;C、容量瓶为精确计量仪器,不能用作溶解,溶解应在烧杯中进行,错误;D、分液时,下层液体从分液漏斗的下口放出,上层液体应从分液漏斗的上口倒出,错误。
本题难度:简单
3、实验题 重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,是一种重要的无机盐产品,可作氧化剂,在印染、颜料、电镀、医药等工业方面有广泛的用途。某化学兴趣小组设计实验测定市场上的红矾钠中Na2Cr2O7的质量分数,其步骤如下:
I.称取Wg红矾钠,溶于酸配成l00mL溶液;
Ⅱ.用cmol·L-1的标准KMnO4酸性溶液滴定20.00mL一定浓度的FeSO4溶液,消耗KMnO4溶液20.00rnL;
Ⅲ。取20.00mL Na2Cr2O7溶液,用上述FeSO4溶液滴定,达到滴定终点时,消耗24.00mLFeSO4溶液;
查阅资料知:Cr2O72-在酸性条件下具有强氧化性,易被还原为Cr3+
回答下列问题:
(1)Na2Cr2O7与FeSO4的反应离子方程式为???????????.
(2)步骤Ⅱ中的滴定过程,滴定终点的现象为???????;选用??????(填“酸式”或“碱式”)滴定管。
(3)已知:MnO4-+5Fe2++8H+==Mn2++5Fe3++4H2O,此红矾钠中Na2Cr2O7的质量分数的表达式为?????????。
(4)判断下列操作对Na2Cr2O7的质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”):
①步骤Ⅲ中的滴定过程,滴定终点读数时俯视读数??????;
②配制c mol·L-1的KMnO4标准溶液时,转移时有少量溶液洒出???????。
(5)[实验探究]有同学提出FeSO4有很强的还原性,在空气中易被氧化而变质,因此对测定结果会造成影响,请你分析后指出,如果FeSO4变质,对测定结果的影响是??????(填“偏高”、“偏低”或“无影响”)。
请设计一个简单实验检验FeSO4溶液是否变质??????????????。
参考答案:(16分)
(1)Cr2O72-+6Fe2++14H+
本题解析:
试题分析:
(1)根据题意确定氧化还原反应中反应物、生成物并配平;
(2)由元素及化合物性质知待测液中Fe2+浅绿色,当滴定完成时MnO-4为浅紫色;盛放酸性、氧化性试剂应该选择酸式滴定管。
(3)根据题中比例关系,可知c(Na2Cr2O7)= cmol·L-1,Na2Cr2O7的质量分数为 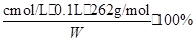 = =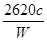 ?%。 ?%。
(4)①中俯视读数会使V标(FeSO4)偏小。②中溶液洒出,会使c(FeSO4)偏大,
(5)即使FeSO4变质,用KMnO4标准溶液也可准确测出溶液中FeSO4真实浓度,故对结果无影响。
本题难度:一般
4、选择题 在配制一定物质的量浓度的NaCl溶液时,下列操作会造成所配溶液浓度偏高的是
A.在用托盘天平称量所需NaCl的质量时,左盘放砝码右盘放NaCl
B.定容时俯视刻度线
C.转移时,把烧杯和玻璃棒用蒸馏水洗涤并把洗涤液也转移至容量瓶
D.容量瓶中有少量水,转移溶液前将容量瓶烘干
参考答案:B
本题解析:A错,在用托盘天平称量所需NaCl的质量时,左盘放砝码右盘放NaCl,若称取的过程中没有用到游码的,则所配溶液浓度不变,若用到游码的,则所配溶液浓度减少;B正确;C错,转移时,把烧杯和玻璃棒用蒸馏水洗涤并把洗涤液也转移至容量瓶所配溶液浓度准确;D错,容量瓶中有少量水,转移溶液前将容量瓶烘干所配溶液浓度无影响;
本题难度:简单
5、实验题 亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案: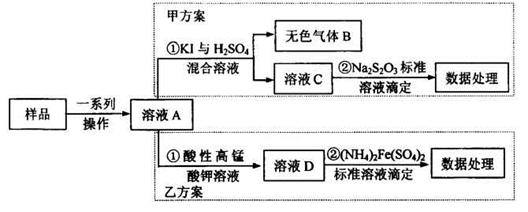
(1)无色气体B遇空气显红棕色,B的化学式为_______写出甲方案①中反应的离子方程式_______
(2)完成并配平乙方案①中反应的离子方程式
MnO4-+??NO2-+?????????=???Mn2++???NO3-+?????????,
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、_______配制溶液时,定容的操作方法是______
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾溶液(过童)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中NaNO2的质量为_______mg.
参考答案:(14分)
(1)NO?(1分),? 2I- +2NO
本题解析:
试题分析:工艺流程的解题的关键,搞清楚加入了什么物质,发生什么反应(氧化还原反应居多),如何分离等。方案甲和乙分别为氧化还原反应,甲方案用到亚硝酸根的氧化性,方案乙用到亚硝酸根的还原性,两方程式分别为,甲:2I- +2NO2-+4H+ =I2+ 2NO↑+2H2O;乙:2MnO4-+ 5NO2-+ 6 H+? =" 2" Mn2+? + 5NO3-+ 3H2O;然后甲用Na2S2O3滴定I2,乙用(NH4)2Fe(SO4)2滴定过量高锰酸钾;根据滴定的量可以计算。(4)5Fe2+~MnO4-;n(MnO4-)=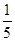 ×0.0010×0.01=2×10-6mol,乙方案中消耗的高锰酸钾为0.012L×0.0005mol/L-2×10-6mol=4×10-6mol;n(NaNO2)= ×0.0010×0.01=2×10-6mol,乙方案中消耗的高锰酸钾为0.012L×0.0005mol/L-2×10-6mol=4×10-6mol;n(NaNO2)=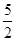 ×4×10-6mol=10-5mol,故每kg中含有690/amg。 ×4×10-6mol=10-5mol,故每kg中含有690/amg。
本题难度:一般
|