微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应:L(s)+aG(g)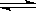 bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。

据此可判断( )
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.a +1<b
参考答案:B
本题解析:由图可知,随温度升高,G的体积分数减少,即升高温度平衡向正反应方向移动,即可得正反应方向为吸热反应,A错,B正确;
由图可知,随压强的增大,G的体积分数增大,即增大压强平衡向逆反应方向移动,即逆反应为气体体积减少的反应,得a <b,C、D均错;
本题难度:一般
2、填空题 水煤气转化反应CO(g)+H2O(g)  CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
完成下列填空:
(1)写出该反应的平衡常数表达式K=________________。
(2)一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是 (选填编号)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO) = c(H2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验组1和实验组2的数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
H2O
| CO
| H2
| CO
|
1
| 650
| 2
| 4
| 1.6
| 2.4
| 3
|
2
| 650
| 1
| 2
| 0.8
| 1.2
| 5
|
3
| 950
| 1
| 2
| —
| —
| —
①由实验组1的数据可知,平衡时CO的转化率为 %。
②由实验组1和2的数据可分析,压强对该可逆反应的影响是 。
③有了实验组1和2的数据,再设计实验组3,其目的是 。
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)可逆反应CO(g)+H2O(g)?CO2(g)+H2 (g)的化学平衡常数k= ; ;
(2)a.反应前后气体的物质的量不发生变化,容器中始终压强不变,不能说明反应到达平衡,故A错误; b.l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故B正确; c.根据反应可知,自始至终v正(CO)=v正(H2O),若v正(CO)=v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,故C正确; d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故D错误;故选:bc;
(3)①、由表中数据可知,实验1组3min到达平衡,平衡时CO的物质的量变化量为4mol-2.4mol=1.6mol,故CO的转化率为1.6/4×100%=40%,故答案为:40;
②、由表中数据可知,实验1组压强为实验2组的2倍,实验1组压强增大到达平衡时缩短,故增大压强反应速率加快,平衡时各组分的物质的量为实验2组的2倍,增大压强反应物转化率不变,化学平衡不移动,故答案为:增大压强反应速率加快;增大压强反应物转化率不变,化学平衡不移动;
③、根据控制变量法分析,实验3与实验1、2组相比温度升高,压强对平衡不影响,故应是探究温度对该反应平衡的影响,对反应速率的影响,
故答案为:探究温度对该反应平衡的影响,对反应速率的影响.
考点:本题考查化学平衡常数、化学平衡状态的判断、化学平衡有关计算、化学平衡的影响因素等,难度不大,注意利用控制变量法探究外界条件对反应速率、化学平衡的影响.
本题难度:困难
3、选择题 在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3 mol/L
B.Y2为0.1 mol/L
C.X2为0.2 mol/L
D.Z为0.4 mol/L
参考答案:A
本题解析:
试题分析:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X2(气)+Y2(气) 2Z(气), 2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X2(气)+Y2(气) 2Z(气), 2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4选A.
考点:考查可逆反应的特征。
本题难度:一般
4、选择题 对于可逆反应2AB3(g)?A2(g)+3B2(g),正反应吸热,下列图象正确的是( ) A.
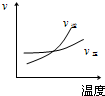
B.
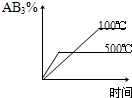
C.
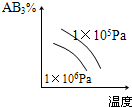
D.
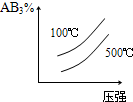
参考答案:BD
本题解析:
本题难度:一般
5、填空题 (8分)在0.1 mol/L氨水中,分别加入少量下列物质,溶液中的c(OH-)如何变化?(填“增大”、“减小”或“不变”)
⑴加少量HNO3溶液____________ ⑵加少量KOH溶液___________
⑶加少量(NH4)2SO4固体__________ (4)加大量水__________
参考答案:(1)减小 (2)增大 (3
本题解析:考查外界条件对电离平衡的影响。一水合氨的电离方程式为NH3·H2O NH4++OH-,因此加少量HNO3溶液平衡向右移动,c(OH-)减小;加少量KOH溶液平衡向逆反应方向移动,但c(OH-)增大;加少量(NH4)2SO4固体平衡向逆反应方向移动,c(OH-)减小;加水有利于电离,但碱性会降低,即c(OH-)减小。 NH4++OH-,因此加少量HNO3溶液平衡向右移动,c(OH-)减小;加少量KOH溶液平衡向逆反应方向移动,但c(OH-)增大;加少量(NH4)2SO4固体平衡向逆反应方向移动,c(OH-)减小;加水有利于电离,但碱性会降低,即c(OH-)减小。
本题难度:一般
|