微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2001年报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录。图示意的是该化合物的晶胞结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为

A.MgB
B.Mg3B2
C.Mg2B
D.Mg2B2
2、选择题 碳元素有三种原子: 、
、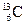 、
、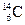 ,则三种原子具有不同的
,则三种原子具有不同的
A.核电荷数
B.中子数
C.电子层数
D.核外电子数
3、选择题 能说明 碳元素的非金属性比硅元素强的是
A.甲烷比硅化氢稳定
B.碳与SiO2反应生成硅
C.碳酸与硅酸钠溶液反应生成硅酸
D.高温下SiO2和Na2CO3反应
4、选择题 只用一种试剂,可区别Na2SO4、AlCl3、NH4Cl、MgSO4四种溶液,这种试剂是
A.HCl
B.BaCl2
C.NaOH
D.AgNO3
5、选择题 右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
?
| ?
| ?
| ?
| a
|
?
| ?
| b
| c
| ?
|
d
| e
| ?
| ?
| ?
|
?
| ?
| ?
| f
| ?
A.b、c、d 三种元素的原子半径大小关系:d> c> b
B.六种元素中,d元素的性质最稳定
C.c和f的气态氢化物,前者比后者稳定
D.e元素的最高价氧化物的水化物是二元酸
题型:单选题难度:偏易来源:不详 答案 C
网站客服QQ: 960335752 - 14613519 - 791315772
|