微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲醛分子式为CH2O,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质.下列关于其结构及性质的分析正确的是( )
A.C原子采取sp3杂化,O原子采取sp杂化
B.甲醛分子中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构
C.甲醛分子与水分子间可以形成氢键,甲醛分子间不能形成氢键
D.甲醛分子为非极性分子
2、填空题 【三选一—物质结构与性质】??
已知和碳元素同主族的X元素位于周期表中的第一长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成的化合物的分子式是XY4。
试回答: ??
(1)X元素原子基态电子的排布式为____;Y元素原子最外层电子的轨道表示式为___。 ??
(2)若X、Y两元素电负性分别为1.8和3.0,则XY4中X与Y 之间的化学键为____(填“共价键”或“离子键”)。 ??
(3)该化合物的空间结构为____,中心原子的杂化类型为?___,分子为____(填“极性分子”或“非极性分子”)。 ??
(4)该化合物在常温下为液体,该化合物中分子间作用力是___。 ??
(5)该化合物的沸点与SiCl4比较,____(填化学式)的较高,原因是____。
3、填空题 (三选一)【选修3:物质结构与性质】
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、氧三种元素中,原子核外电子未成对电子数最多的是____________(用元素符号表示)。
(2)尿素[CO(NH2)2]和乙酸(CH3COOH)的相对分子质量均为60,但状态却不同,常温下尿素为稳定的固体,乙酸为易挥发的液体。出现这种现象的原因是______________________________________。
(3)CH4、NH3、H2O三种氢化物分子中的中心原子碳原子、氮原子、氧原子的杂化状态是否相同__________,三种分子中的键角大小顺序是__________(用化学式表示)。
(4)MgO与NaCl晶胞同为面心立方结构,MgO晶胞体积为7.62×10-23cm3,NA=6.02×1023mol-1,那么MgO的晶胞密度为____________g/cm3(保留两位小数,密度=品胞中MgO的质量/晶胞体积)。
4、选择题 基态氮原子的电子排布为1s22s22p3,则氮原子的p轨道上三个电子的排布式为 [???? ]
A.
B.
C.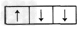
D.
5、选择题 下列分子中,中心原子以sp3杂化的是[???? ]
A.NH3
B.BF3
C.CO2
D.BeCl2