微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 右图是制取和收集某气体的实验装置,该装置可用于
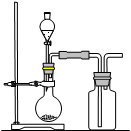
A.用浓硫酸和氯化钠反应制取HCl
B.用浓氨水和生石灰反应制取NH3
C.用双氧水与二氧化锰反应制取O2
D.用饱和食盐水和电石反应制取C2H2
参考答案:C
本题解析:
试题分析:根据装置图可知,该反应适合于制备不需要加热、且密度大于空气的气体。选项AB都需要加热,C正确;D中乙炔的密度小于空气的,不正确,答案选C。
点评:该题主要是考查学生对常见气体制备原理以及收集方法的了解程度,属于基础性试题的检验,难度不大。该题的关键是记住气体的制备原理和气体的性质,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 不能用排水集气法收集的气体是
A.02
B.HCl
C.H2
D.NO
参考答案:B
本题解析:
试题分析:氯化氢极易溶于水,所以不能用排水法收集,其余都是可以的,答案选B。
点评:点评:气体的收集方法是:1.排水法适用于不易溶于水的气体。例如氢气,氧气。2,向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气。3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。
本题难度:简单
3、实验题 (14分)
某化学小组用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,其实验流程如下所示:
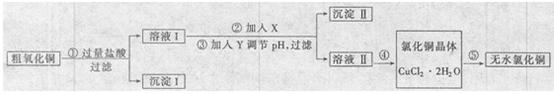
(1)步骤①中氧化铜与盐酸反应的离子方程式是????????。
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是
????????。
(3)已知:
?
| 氢氧化物开始沉淀时的pH
| 氢氧化物沉淀完全时的pH
|
Fe3+
| 1.9
| 3.2
|
Fe2+|
| 7.0
| 9.0
|
Cu2+
| 4.7
| 6.7
|
提供的试剂:a. NaOH??? b. H2O2????c. Na2CO3???d. CuO
参照表中给出的数据和试剂,请回答:
步骤②的目的是????????,反应的离子方程式是???????????。步骤③中调节溶液pH的范围是????????????,试剂Y是????????(填字母)。
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·2H2O,其原因是????????。
参考答案:
(1)CuO+2H+=Cu2++H2O
(2)
本题解析:略
本题难度:一般
4、填空题 软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下:
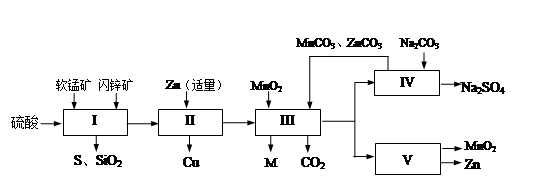
(1)I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式:???????????????????????????????????????????????;
(2)已知Fe(OH)3、Al(OH)3、Zn(OH)2三种物质开始沉淀和完全沉淀时溶液的pH如下表:
沉淀物
| Fe(OH)3
| Al(OH)3
| Zn(OH)2
| 开始沉淀pH
| 2.3
| 4.0
| 5.6
| 完全沉淀pH
| 4.1
| 5.2
| 8.0
?
则III中调节溶液的pH至5.2~5.4,此时生成沉淀M的成分为??????????(写化学式),III中加入MnO2的作用是????????????????????????????????????????????;
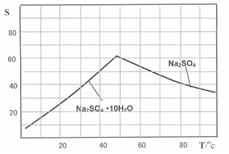
(3)Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水)如图,则IV中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、???????????、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是?????????????????????;
(4)V是用惰性电极电解制得Zn和MnO2,则阳极的电极反应式为????????????????????;
(5)绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的主要物质有:MnO2、ZnCO3、MnCO3、???????和??????(写化学式)。
参考答案:(16分)
(1)MnO2 + CuS+ 2H2SO4
本题解析:
试题分析:(1)依题意,MnO2、CuS、H2SO4反应生成MnSO4、CuSO4、S、H2O,锰元素由+4降为为+2价,硫元素由—2升为0价,根据最小公倍数法配平,则该反应为MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O;(2)根据表中信息,若溶液pH调至5.2~5.4,则溶液中的铁离子、铝离子都被完全除去,分别变为氢氧化铁沉淀、氢氧化铝沉淀,所以沉淀M的成分为Fe(OH)3、Al(OH)3;II中加入适量Zn,充分反应后过滤,得到Cu,由此推断发生的反应为Zn+Cu2+=Zn2++Cu、Cu+2Fe3+=Cu2++2Fe2+,则II的滤液中无铁离子,只有亚铁离子,为了将亚铁离子除去,需要先将其氧化为铁离子,再调节溶液pH将其完全变为氢氧化铁沉淀,因此III中加入的二氧化锰是将Fe2+氧化成Fe3+的氧化剂,即MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(3)读图,硫酸钠的溶解度随温度降低逐渐增大,而十水硫酸钠的溶解度随温度降低明显减小,由此说明从IV溶液中制取硫酸钠固体的方法是蒸发浓缩、趁热过滤、洗涤、干燥,而制取十水硫酸钠固体的方法是蒸发浓缩、冷却结晶、洗涤、干燥;用乙醇洗涤硫酸钠固体时,不会析出十水硫酸钠,用水洗涤硫酸钠固体时,随着温度的降低,硫酸钠溶解度增大,容易洁净析出十水硫酸钠固体;(4)电解前,V溶液中含有锌离子、锰离子,由此推断电解时锌元素由+2降为0价,得到电子,发生还原反应,说明Zn是阴极产物;锰元素由+2升为+4价,失去电子,发生氧化反应,说明二氧化锰是阳极产物,即Mn2+—2e-→MnO2;左边带4个正电,右边不带电,呈酸性的V溶液中只能用氢离子使左右电荷守恒,则Mn2+—2e-→MnO2+4H+;左边比右边少4H、2O,根据原子个数守恒可得阳极反应式:Mn2+—2e-+2H2O=MnO2+4H+;(5)根据流程图中主要步骤的反应物和生成物推断,V的生成物有二氧化锰、锌、硫酸,它们分别是III、II、I的反应物,IV产生的碳酸锌是III的反应物,它们都可以循环利用。
本题难度:一般
5、实验题 (15分)甲、乙两同学分别都用到铜与硫酸完成下列相关实验,请回答相应的问题.
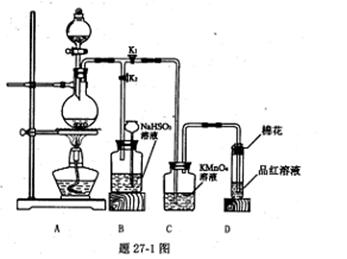
(1)甲同学用题27-1图所示装置实现铜跟浓硫酸反应制取少量硫酸铜溶液,并验证相关物质的性质.
①装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是_____.
②从C、D装置中观察到的现象,说明上述反应的某种生成物所具有的化学性质是????????????、__????????????__.
③装置B将用来储存多余气体,当D处有明显的现象后,关闭旋塞K.,打开K2移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_????????????.
(2)乙同学认为:铜虽不能与稀硫酸直接反应生成硫酸铜,但可以在稀硫酸与铜粉的混合物中分多次加入适量浓硝酸而得到不含NO3—的硫酸铜溶液.其装置如题27-2图所示.
①把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是____????????????
②已知NO不能被NaOH溶液直接吸收:但已知有如下两个反应:
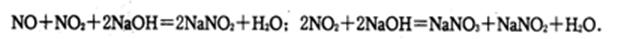
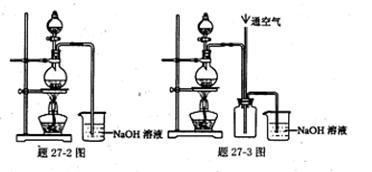
题27-3图是题27-2图的改进装置,其优点除可以防止倒吸外还有___????????????_
③将反应所得硫酸铜溶液经___???????_、????????????、过滤、洗涤、干燥即可得到胆矾晶体.
④如果用1mol Cu来制取lmol CuSO4,则所需浓硝酸中HNO3的质量为????????????_,(假设HNO3的还原产物全为NO),若所得尾气恰好被NaOH溶液吸收并生成NaNO2,需通入空气的体积为____.(假设气体体积为标准状况下测定,空气中氧气占总体积的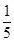 ,保留小数点后一位,并忽略装置中原有空气的影响) ,保留小数点后一位,并忽略装置中原有空气的影响)
参考答案:(1)①吸收多余的二氧化硫,防止污染空气(2分)???
本题解析:(1)①SO2是大气污染物,需要进行尾气处理,可用氢氧化钠吸收多余的SO2,防止污染空气。
②SO2具有还原性,能被酸性高锰酸钾溶液氧化,而使其褪色。同时SO2还具有漂白性,能使品红溶液褪色。
③由于SO2在饱和亚硫酸氢钠中溶解度很小,所以试剂瓶中压强会逐渐增大,因此试剂瓶中液面下降,而长颈漏斗中液面上升。
(2)①如果硝酸过量,则会生成硝酸铜。所以分次加入能确保所有的硝酸都作氧化剂,在溶液中将铜氧化,只生成硫酸铜。
②由于NO不能钡吸收,但在氧气的作用下能钡氧化生成NO2,从而确保有害气体能被完全吸收。
③要得到硫酸铜晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤和干燥等过程。
④1mol铜失去2mol电子,所以根据电子得失守恒可知,需要硝酸的物质的量是2/3mol,其质量是2/3mol×63g/mol=42g。生成NO是2/3mol,而氧化产物是亚硝酸钠,所以反应中转移电子是2/3mol。设空气的体积为VL,则根据电子得失守恒可知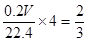 ,解得V=18.7L。 ,解得V=18.7L。
本题难度:一般
|
|