微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、判断题 (12分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是
_______________________________________________。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
________________________。
(3)在一定条件下,甲与O2反应的化学方程式是________________________。
(4)丁的元素符号是____________,它的晶体类型是____________。
(5)丁的氧化物的晶体结构与____________的晶体结构相似。
参考答案:(1)CaC2+2H2O====C2H2↑+Ca(OH)2<
本题解析:(1)丙为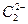 ,与Ca2+结合为CaC2,跟水反应生成C2H2。
,与Ca2+结合为CaC2,跟水反应生成C2H2。
(2)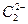 具有14个电子,则具有14电子的还原性微
具有14个电子,则具有14电子的还原性微
本题难度:简单
2、计算题 我国大约在南北朝时就能铸造铜锌合金—黄铜。某化学兴趣小组为了测定得到的黄铜样品中铜的含量,称取20g样品研细后放置于烧杯中,加入50g稀硫酸,恰好完全反应后,冷却,称得烧杯的总质量为69.8g。请计算(计算结果精确到0.1%):
(1)此黄铜中铜的质量分数;(2)所得溶液的溶质质量分数。
参考答案:此黄铜中铜的质量分数是67.5%,所得溶液的溶质质量分数是2
本题解析:由质量守恒定律得,反应所生成的氢气为:20g+50g -69.8g ="0.2g"
(1)设此黄铜中锌的质量为x,反应消耗H2SO4的质量为y,生成ZnSO4的质量为z
Zn +H2SO4=ZnSO4+H2↑
65?? 98?????? 161? 2
x??? y???????? z? 0.2g
65g/x=2g/0.2g;98g/y=2g/0.2g;161g/z=2g/0.2g
解得:x=6.5g? y=9.8g? z=
本题难度:简单
3、选择题 下列物质的用途正确的是(?)
A.用Na2O2漂白食品,而SO2不能用于干果防腐
B.用石英砂制太阳能电池
C.高温下用铝热法炼铁制备钢材
D.工业上可用氯化钠制备化肥NH4Cl
参考答案:D
本题解析:
试题分析:A、Na2O2和SO2都不能用来漂泊食品,错误;B、可用于制造太阳能电池的材料为单质硅,错误;C、利用CO等还原剂还原铁矿石炼铁,错误;D、把NH3、CO2通入饱和食盐水,可制得NaHCO3和NH4Cl,正确。
本题难度:一般
4、选择题 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
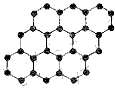 [???? ]
[???? ]
A.石墨烯中的碳原子之间以共价键相结合
B.石墨烯是一种有机化合物
C.石墨烯完全燃烧的产物不止一种
D.12kg石墨烯中含6.02×1023个碳原子
参考答案:A
本题解析:
本题难度:简单
5、选择题 下列有关化学知识在生产、生活中应用的叙述正确的是(?)
①工业上合成新型氮化硅(Si3N4)陶瓷需要在高温、空气气氛中进行 ②钢铁制品锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳 ③海水淡化和工业生产及生活废水的再利用,是解决缺水问题的有效途径 ④高铁酸钠(Na2FeO4)和ClO2都能作净水剂,其原理完全相同 ⑤液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰
A.①②③
B.②④
C.③④⑤
D.③⑤
参考答案:D
本题解析:①合成Si3N4陶瓷应隔绝空气;②若将生铁中的碳全部除去,得到纯铁,其机械性能远远低于铁合金的;④Na2FeO4作净水剂有两个作用:一是+6价的铁具有极强的氧化性,从而起到杀菌消毒效果,二是+6价的铁被还原为+3价铁,Fe3+水解产生Fe(OH)3胶体,吸附水中的悬浮物从而起到净水作用,而ClO2作净水剂时,只是利用其氧化性起到杀菌消毒效果;⑤Cl2能与Ca(OH)2溶液反应而被除去。
本题难度:一般