微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)将反应2FeCl3+Fe=3FeCl2设计成原电池。____________________
(2)判断正负极并写出电极反应。________________________
参考答案:(1)![]() 本题解析:
本题解析:
本题难度:一般
2、选择题 某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则

A.电流方向:电极IV→ →电极I
→电极I
B.电极I发生还原反应
C.电极II逐渐溶解
D.电极III的电极反应:Cu2++2e-==Cu
参考答案:A
本题解析:
试题分析:A、由题意可知,该装置的I、II是原电池的两极,I是负极,II是正极,III、IV是电解池的两极,其中III是阳极,IV是阴极,所以电流方向:电极IV→ →电极I,正确;B、电极I是原电池的负极,发生氧化反应,错误;C、电极II是原电池的正极,发生还原反应,有Cu析出,错误;D、电极III是阳极
→电极I,正确;B、电极I是原电池的负极,发生氧化反应,错误;C、电极II是原电池的正极,发生还原反应,有Cu析出,错误;D、电极III是阳极
本题难度:一般
3、填空题 (12 分)能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(l)已知:在 25 ℃、101 kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ 。请写出甲醇燃烧的热化学方程式?????????????????。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+ 3H2 (g) CH3OH(g)+H2O (g ).在其它
CH3OH(g)+H2O (g ).在其它 条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)

①合成甲醇反应的△H??0。(填“>”、“<”或“=”)。
②平衡常数的表达式为:??????????????????????.温度为T2时的平衡常数????温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1 molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为???????????????。
(3)利用甲醇燃料电池设计如下图所示的装置。
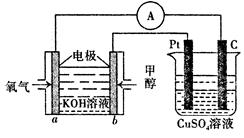
该装置中 Pt 极为???????极;写出 b极的电极反应式??????????????????????????.
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
4、填空题 (6分)用铜、银与硝酸银设计一个原电池,此电池的负极是:??????????????????,
负极的电极反应式是:????????????????????????????????????????????????????????,
总反应方程式为??????????????????????????????????????????????????????????????。
参考答案:负极是 Cu ,负极的电极反应式 Cu - 2e- ="="
本题解析:略
本题难度:简单
5、选择题 甲烷燃料电池的化学反应为CH4 + 2O2 = CO2 + 2H2O,其中1个电极反应式为
2O2 + 8H4 + 8e- = 4H2O下列叙述不正确的是(???)
A.CH4通入负极
B.O2通入正极
C.正极发生氧化反应
D.负极的电极反应式为:CH4 + 2H2O– 8e- = CO2 + 8H+
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。甲烷在反应中失去电子,所以甲烷在负极通入,氧气在正极通入,发生还原反应,C不正确。总反应式减去正极反应式即得到负极反应式,D正确。答案选C。
本题难度:一般