微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 浓硝酸与下列物质反应,其中硝酸既表现酸性又表现氧化性的是
A.Cu
B.C
参考答案:
本题解析:
本题难度:一般
2、填空题 (9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。

(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。
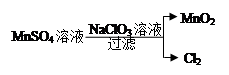
参考答案:(1)cd (2分)
(2)正(1分) Cu2++2e
本题解析:
试题分析:(1)Na、Mg为活泼金属,无法用还原剂还原化合物制取金属单质,Fe可用还原剂还原化合物制取金属单质,Ag可用加热Ag2O的方法制取Ag,故cd项正确。
(2)电解精炼铜,粗铜为阳极,连接在电源的正极;b极为阴极,电解质溶液中的Cu2+在阴极上得电子,电解方程式为:Cu2++2e?=Cu。
(3)已知X为单质,在反应中NaN3失去电子,可推出X为N2,KNO3中N元素化合价降低,在反应中得电子,所以KNO3为氧化剂;根据氧化反应中氧化剂所得电子总数与还原剂失去电子总数相等,可得n(NaN3)=5n(KNO3),所以氧化剂和还原剂的物质的量之比,即n(KNO3):n(NaN3)=1:5.
(4)根据图示可知,ClO3?把Mn2+氧化为MnO2,可得离子方程式为:5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+
考点:本题考查金属的冶炼、电解精炼铜、氧化还原反应原理及应用、离子方程式的书写。
本题难度:一般
3、选择题 已知土壤胶体微粒带负电荷,在土壤里施用含氮质量相等的下列肥料,肥效较差的是
A.(NH4)2SO4
B.NH4HCO3
C.NH4NO3
D.NH4Cl
参考答案:C
本题解析:因土壤胶粒带负电荷,故能吸附阳离子,而NH4NO3中NO3-不能被吸附,就会流失,损失了氮元素,肥效最差
本题难度:简单
4、选择题 工业上可利用反应2NaClO3 + SO2 + H2SO4= 2ClO2 + 2NaHSO4来制取ClO2,下列关于该反应的说法正确的是
A.SO2发生还原反应
B.NaClO3失去电子
C.H2SO4作氧化剂
D.1mol氧化剂得到1mol电子
参考答案:D
本题解析:
试题分析:A、二氧化硫中S元素的化合价升高到+6价,所以二氧化硫发生氧化反应,错误;B、NaClO3中Cl元素的化合价降低到+4价,所以得到电子,错误;C、硫酸中S元素的化合价未发生变化,所以硫酸不是氧化剂,也不是还原剂,起到酸性作用,错误;D、该反应中的氧化剂是NaClO3,Cl元素的化合价降低1价,所以1mol氧化剂得到1mol电子,正确,答案选D。
考点:考查对氧化还原反应的分析
本题难度:一般
5、填空题 (10分) KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为:
2KClO3 + 4HCl(浓) =" 2" KCl + 2 ClO2↑ + Cl2↑ + 2 H2O
(1)用“双线桥法”标出电子转移的方向和数目。
(2)浓盐酸在反应中显示出来的性质是 (填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1 mol Cl2,则转移的电子的数目为 ,标况下该反应产生气体体积为
(4)还原剂和还原产物物质的量之比
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2.电子转移的方向和数目为: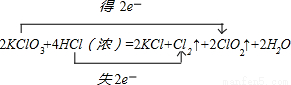
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各中一半.选:②;(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol,数目为0.2x6.02×1023=1.204×1023, 根据2KClO3 + 4HCl(浓) =" 2" KCl + 2 ClO2↑ + Cl2↑ + 2 H2O,产生的气体为0.3moL,体积为0.3x22.4=6.72L;(4)2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O反应中,还原剂为2HCl,还原产物为2ClO2↑,所以还原剂和还原产物物质的量之比为1:1.
考点:考查氧化还原反应的基本理论与计算,物质的性质等知识。
本题难度:一般