微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)小王同学准备用CuSO4·5H2O配制500 mL 1 mol/L的溶液。
(1)小王同学选用的容量瓶容积的规格是 mL;
(2)玻璃棒在该实验中有重要的用途,分别是 和 ;
(3)小王同学通过计算,用托盘天平称取 g CuSO4·5H2O。
(4)配制好的溶液呈 色。小王同学还想通过实验证实溶质中含有SO42-,请你帮他想想办法,选择适当的试剂,并写出其相应的实验步骤、现象以及离子方程式。
溶质
| 实验步骤
| 实验现象
| 离子方程式
|
SO42-
|
|
|
(5)物质的量浓度误差分析:(填偏高、偏低、无影响)
①若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将 ;
②定容时,若眼睛俯视,则所配制的溶液浓度将 。
参考答案:24.(10分) (1). 500 m
本题解析:
试题分析:(1)选取容量瓶规格应该稍微大于或等于配制溶液体积,实验室有500mL容量瓶,所以选取容量瓶的规格是500mL;(2)玻璃棒起搅拌和引流作用,所以玻璃棒在该实验中有重要的用途,分别是搅拌和引流。(3)需硫酸铜晶体的质量为m=0.5L×1mol?L-1×250g/mol=125g,答案为:125g(4)Cu2+呈蓝色,所以配制好的溶液呈蓝色,检验SO42-的方法:取少量待测溶液于试管中,加入盐酸酸化,再滴入几滴BaCl2溶液,有白色沉淀生成。所以实验步骤是取少量溶液于试管中,加几滴稀盐酸酸化,再加入几滴氯化钡溶液,实验现象是产生白色沉淀,离子方程式是Ba2++SO42-= BaSO4 ↓;(5)①容量瓶中洗净后未干燥,残留少量水,对实验结果无影响,②定容时,若眼睛俯视,则加入水的体积减少,所配制的溶液浓度将偏高。
考点:考查一定物质的量浓度溶液的配制。
本题难度:一般
2、填空题 (12分)O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为__________,原子个数比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为____ ,原子个数比为______,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________ (用含NA的式子表示)。
参考答案:(1)3:2 1:1 (2)1:1&#
本题解析:
试题分析:(1)设其质量为m,等质量的O2和O3所含分子个数比=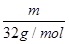 NA: NA: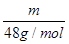 NA=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1; NA=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(3×2):(2×3)=1:1;
(2)温同压下,气体摩尔体积相同,根据N=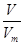 NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m= NA知,等体积的O2和O3所含分子个数比是1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数之比是2:3,根据m=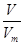 M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3; M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:3;
(3)氧气的摩尔质量为M=m÷n=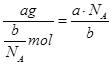 g/mol,则c g O2在标准状况下体积为:V= g/mol,则c g O2在标准状况下体积为:V=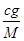 ?Vm= ?Vm=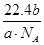 L。 L。
考点:考查常用化学计量数计算、阿伏伽德罗定律及推论
本题难度:一般
3、选择题 设阿伏加德罗常数为6.02×1023 mol-1 。关于1mol H2O的叙述正确的是?
A.含有1mol H2
B.含有6.02×1023个水分子
C.质量为18 g/mol
D.在标准状况下的体积为22.4 L
参考答案:B
本题解析:1mol水中含有1mol水分子,即NA个;不含氢气分子,故A错;质量为18g,C错;标况下,水为液体。
本题难度:一般
4、选择题 下列各组物质中,原子数相同的是( )
A.2 L CO和2 L O2
B.标准状况下2 mol CO2和44.8 L水
C.0.2 mol H2和4.48 L HCl
D.同温同压下,2L氧气和2L氯气与氯化氢的混合气
参考答案:D
本题解析:A:气体并没有标明状况,没有意义;B:水为液态,不用计算即可估算出后者的原子数要大得多;C:同样,气体没有指明状况。选D
本题难度:一般
5、选择题 标准状况下,某种O2和N2的混合气体m?g含有b个分子,则n?g该混合气体在相同状况下所占的体积(L)应是( )
A. 22.4nb
m×6.02×1023
B.22.4mb
b×6.02×1023
C.22.4n×6.02×1023
mb
D.nb×6.02×1023
22.4m
参考答案:A
本题解析:
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|