微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是
A.Na2O和Na2O2组成元素相同,且都能与硫酸溶液反应
B.光导纤维由SiO2制备得到,其属于硅酸盐产品
C.工业上利用电解熔融的MgO来制备镁
D.SO2通入新制氯水中,氯水褪色是因为SO2具有漂白性
参考答案:A
本题解析:分析:A.Na2O和Na2O2分别和硫酸反应生成硫酸钠,过氧化钠还生成氧气;
B.二氧化硅不属于硅酸盐;
C.工业用电解熔融的氯化镁的方法制备镁;
D.二氧化硫与氯气发生氧化还原反应.
解答:A.Na2O可与硫酸反应生成硫酸钠和水,Na2O2与硫酸反应生成硫酸钠、水和氧气,二者所含元素的种类相同,故A正确;
B.二氧化硅不属于硅酸盐,属于氧化物,故B错误;
C.氧化镁熔点太高,工业用电解熔融的氯化镁的方法制备镁,故C错误;
D.二氧化硫与氯气发生氧化还原反应,反应中二氧化硫体现还原性,故D错误.
故选A.
点评:本题考查较为综合,侧重于元素化合物知识的考查,涉及钠的重要化合物、二氧化硅、镁的冶炼以及二氧化硫的性质,题目难度不大,注意元素化合物知识的综合应用.
本题难度:简单
2、选择题 下列物质间的反应不能产生气体的是
A.Na与H2O
B.Na2O2和H2O
C.Na2O和稀H2SO4
D.NaHCO3和稀H2SO4
参考答案:C
本题解析:
本题难度:困难
3、选择题 下列有关物质的性质和应用均正确的是
A.NH3能氧化氮氧化物,可用于汽车尾气净化
B.瓷坩埚能耐高温,可用于加热分解石灰石
C.Fe在O2中的燃烧产物可用于制红色涂料
D.Mg (OH)2受热能分解,可用作阻燃剂
参考答案:D
本题解析:
试题分析:NH3中的N处于最低价态,只能做还原剂。瓷坩埚成分中有SiO2能与CaCO3反应。Fe在O2中的燃烧产物是Fe3O4,不是Fe2O3不能做红色涂料。Mg(OH)2受热能分解MgO耐高温,可用作阻燃剂。答案选D。
考点:化合物的性质
点评:解决这类习题必须掌握好各种物质的性质。
本题难度:一般
4、选择题 熔化氢氧化钾固体应选用的仪器是
A.瓷坩埚
B.石英坩埚
C.氧化铝坩埚
D.铁坩埚
参考答案:D
本题解析:瓷坩埚和石英坩埚的主要成分都含有酸性氧化物SiO2,SiO2能与强碱反应,氧化铝坩埚由氧化铝构成,能与强碱反应,只有铁不会与碱反应。
本题难度:一般
5、选择题 把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2?2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2 ;②NaHCO3+HCl=NaCl+H2O+CO2,生成气体为O2与CO2.
将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据二氧化碳是否过量用讨论的方法计算.
解答:2.24L混合气体的物质的量为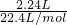 =0.1mol;
=0.1mol;
2.016LO2的物质的量为 =0.09mol.
=0.09mol.
2Na2O2+2CO2=2Na2CO3+O2 △n
2?????? 2????????????? 1
n???????m??????? 0.1mol-0.09mol=0.01mol
n=m=0.02mol,
1、若CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol
2? Na2O2+4? HCl=4NaCl+2H2O+O2
0.16mol?? 0.32mol??????0.08mol
?NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol???? 0.02mol
所以Na2O2为0.16mol,NaHCO3为0.02mol;混合物中Na2O2与NaHCO3的物质的量之比0.16mol:0.02mol=8:1;
消耗的HCl为0.32mol+0.02mol=0.34mol,物质的量浓度为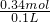 =3.4mol/L.
=3.4mol/L.
2、若CO2未完全反应,则Na2O2应是0.02 mol,
2Na2O2+4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol??????? 0.01mol
则第一份生成O2的为0.01mol,所以CO2为0.1mol-0.01mol=0.09mol.
NaHCO3+HCl=NaCl+H2O+CO2
0.09mol 0.09mol????0.09mol
所以Na2O2为0.02mol,NaHCO3为0.09mol;混合物中Na2O2与NaHCO3的物质的量之比0.02mol:0.09mol=2:9.
消耗的HCl为?0.04mol+0.09mol=0.13mol,物质的量浓度为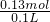 =1.3mol/L.
=1.3mol/L.
故选:D.
点评:本题考查混合物的计算,难度较大,关键是二氧化碳与过氧化钠的反应讨论进行计算.
本题难度:一般