微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O(没有配平).请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:______,鉴别这两种气体不能选用的试剂是______
a.BaCl2溶液??b.KMnO4溶液??c.品红溶液?? d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是______.此时溶液中的离子按照浓度由大到小排列的顺序是______.
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是______?L(标况).将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因______.
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是______
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是______(简述操作过程及结论).
参考答案:(1)C、D两种气体均能使澄清石灰水变浑浊,能使澄清石灰水变
本题解析:
本题难度:一般
2、简答题 (16分) 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
方法1
| 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为:
2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH="+8." 0 kJ·mol-1
2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH="+90." 4 kJ·mol-1
|
方法2
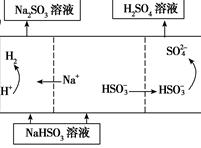
| 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:
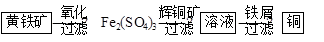
(1)Ⅱ相对于Ⅰ的优点是______________________________。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________(可以写表达式)。
参考答案:(共16分)
(1)①能大大降低能源消耗;利于减少污染
本题解析:
试题分析:(1)①方法二消耗了电能,方法一没有消耗电能,所以能大大降低能源消耗;利于减少污染。
(2)2Cu2O+Cu2S=6Cu+SO2↑反应中铜元素的化合价从+1降低到0,所以氧化亚铜和硫化亚铜都做氧化剂。
(3)反应①:2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ·mol-1,和CO的燃烧热283.0kJ·mol-1,则反应②:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,根据盖斯定律,②×2-①,反应热为-283×2-8=574kJ·mol-1,所以热化学方程式为:S(g)+O2(g)=SO2(g) ΔH=-574.0kJ·mol-1。(4)阳极失去电子化合价升高,从图分析亚硫酸氢根失去电子产生硫酸根离子,电极反应为:HSO3-+H2O-2e-===SO42-+3H+。(5)黄铁矿被氧化成硫酸铁,方程式为:4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4。 2Fe2(SO4)3+2H2SO4。
(6)Cu2S+10Fe3++4H2O=2Cu2++10Fe2++8H++SO42-,Cu2++Fe=Fe2++Cu,2H++Fe=Fe2++H2,根据硫原子守恒,硫元素最后都到硫酸亚铁,所以有关系:15O2----8.4FeSO4,亚铁离子物质的量为8.4V/15,亚铁离子浓度为: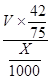 mol/L或560 mol/L或560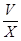 mol/L。 mol/L。
考点:氧化还原反应,盖斯定律,电解原理的应用,原子守恒法计算。
本题难度:困难
3、选择题 (NH4)2Cr2O7是一种受热易分解的盐。下列各组对(NH4)2Cr2O7受热分解产物的判断,符合实际的是
A.CrO3 + NH3 + H2O
B.Cr2O3 + NH3 + H2O
C.CrO3 + N2 + H2O
D.Cr2O3 + N2+ H2O
参考答案:D
本题解析:略
本题难度:一般
4、选择题 .下列有关描述所对应的化学用语正确的是
A.Na2S的水解:S2-+2H2O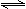 H2S+2OH- H2S+2OH-
B.碳酸的电离方程式:H2CO3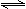 2H++CO32- 2H++CO32-
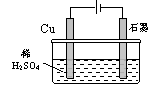
C.右图反应开始时的离子方程式:Cu+2H+ Cu2++H2↑ Cu2++H2↑
D.氢氧碱性燃料电池的负极反应式:H2-2e-=2H+
参考答案:C
本题解析:氢硫酸是二元弱酸,硫离子水解应该分布进行,A不正确。碳酸是二元乳弱酸,电离分布进行,B不正确。C中是电解池,铜和电源的正极相连是阳极,失去电子,阴极是石墨,溶液中的氢离子在阴极放电,C正确。在碱性氢氧燃料电池中,负极反应式是H2-2e-+2OH-=2H2O,D不正确。答案选C。
本题难度:简单
5、选择题 黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时的反应是:
S+2KNO3+3C=K2S+N2↑+3CO2↑,该反应的还原剂是
A.C
B.C和S
C.KNO3
D.S和KNO3
参考答案:A
本题解析:
试题分析:根据反应的方程式可知,S元素的化合价从0价 降低到-2价,S是氧化剂。硝酸钾中氮元素的化合价从+5价降低到0价,硝酸钾是氧化剂。碳元素的化合价从0价升高到+4价,失去电子,因此还原剂是碳,答案选C。
本题难度:简单
|