微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 [化学--物质结构与性质]
四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.
| 元素 | A | B | C | D
结构性质
信息
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同
原子核外有两个电子层,最外层有3个未成对的电子
基态原子的M层有2对成对的p电子
其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价
(1)写出D原子的外围电子排布式______,A、B、C、D四种元素的第一电离能最小的是______(用元素符号表示).
(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点______(填“高”或“低”).
(3)元素F与A相邻且同主族,它们与氧元素的成键情况如下:
A-O
A=O
F-O
F=O
键能(KJ/mol)
360
803
464
640
在A和O之间通过双键形成AO2分子,而F和O则不能和A那样形成有限分子,原因是______.
(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是______(填序号).a.离子键??b.极性键c.非极性键d.配位键????e.金属键
(5)下列分子结构图中的“

”表示上述相关元素的原子中除去最外层电子的剩余部分,“

”表示氢原子,小黑点“

”表示没有形成共价键的最外层电子,短线表示共价键.
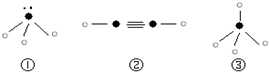

则在以上分子中,中心原子采用sp3杂化形成化学键的是______(填序号);在②的分子中有______个σ键和______个π键.
(6)已知一种分子B4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量.试计算反应:B4(g)═2B2(g)△H=______KJ/mol.
2、填空题 下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题

(1)写出下列元素基态原子的核外电子排布式:
Sc____________________________ Ti_______________________________
V ____________________________ Mn ______________________________
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是 ____________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是____________________________________;出现这一现象的原因是_________________________________。
3、简答题 A+、B+、C-、D、E五种微粒(分子或离子),每个微粒均含有10个电子.已知:①A++C- 加热
D+E↑????②B++C-→2D
请回答以下问题:
(1)C-离子含有的化学键为______.
(2)具有相同空间构型的微粒是______和______.
(3)分别写出A+和D反应,B+和E反应的离子方程式.
A++D:______B++E:______.
4、选择题 同一个原子的下列电子层中,能量最高的是[???? ]
A.L层
B.K层
C.N层
D.M层
5、选择题 下列说法中错误的是( )
A.电子排布式1s22s22p63s23p63d3违反了能量最低原理
B.6C的电子排布式1s22s22px2违反了洪特规则
C.同一原子中一定没有能量相同的电子
D.电子排布式1s22s22p63s23p10违反了泡利原理
|