微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语正确的是(?)
A.HCl的电子式
B.Cl-的结构示意图
C.CO2的电子式
D.质量数为37的氯原子37Cl
参考答案:B
本题解析:氯化氢是共价键形成的共价化合物,电子式为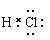 。在CO2中碳和氧形成的是碳氧双键,电子式为
。在CO2中碳和氧形成的是碳氧双键,电子式为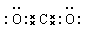 。在表示原子的组成时,元素符号
。在表示原子的组成时,元素符号
本题难度:一般
2、选择题 (3分)对于反应3Cl2 + 6NaOH ="=5NaCl" + NaClO3 + 3H2O,以下叙述正确的是
A.Cl2是氧化剂,NaOH是还原剂
B.每生成1mol的NaClO3转移6mol的电子
C.Cl2既是氧化剂又是还原剂
D.被氧化的Cl原子和被还原的Cl原子的物质的量的比为5∶1
参考答案:C
本题解析:
试题分析:A、在3Cl2 + 6NaOH ="=5NaCl" + NaClO3 + 3H2O反应中,Cl元素的化合价在反应前后发生变化,其他元素的化合价未发生变化,所以氯气既是氧化剂又是还原剂,错误;B、Cl元素的化合价从0价升高到+5价,所以每生成1mol的NaClO3,转移5mol的电子,错误;C、正确;D、Cl元素的化合价升高到+5价,被氧化,降低到-1价,被还原,所以被氧化的Cl原子和被还原的Cl原子的物质的量的比为1:5,错误,答案选C。
考点:考查对氧化还原反应的分析
本题难度:一般
3、填空题 利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①将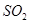 通入酸性
通入酸性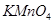 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是?????????。
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是?????????。
A.S2-
B.S
C.SO32-
D.SO42-
②亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。
请选取合适的试剂证明Na2SO3具有还原性, 并写出该反应的离子方程式为:??????????????????????????????????.
(2)从物质分类的角度可以推测物质的性质。
①已知蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。其中属于碱性氧化物的是?????????????????????????????。
②现取一份蛇纹石试样进行实验:
I.先将其溶于过量的盐酸中、过滤,滤渣的主要成分是????????。
II.再向滤液中加入NaOH溶液至过量、过滤,滤渣中的主要成分是????????。
参考答案:(1)①D
②SO32-+Br2+H2O=2H++SO
本题解析:
试题分析:(1)①二氧化硫被酸性高锰酸钾氧化,化合价升高,所以答案选+6价的SO42-,答案选D。
②证明Na2SO3具有还原性,使亚硫酸钠与溴水反应,生成硫酸和溴化钠。离子方程式为SO32-+Br2+H2O=2H++SO42-+2Br-
(2) ①碱性氧化物是指能与酸反应生成盐和水的氧化物,所以属于碱性氧化物的是MgO、Fe2O3,氧化铝属于两性氧化物;
②蛇纹石的成分中只有SiO2不与盐酸反应,所以滤渣的主要成分是SiO2;酸溶后的溶液中含镁离子、铝离子、铁离子,加入过量氢氧
本题难度:一般
4、选择题 向Fe和Fe2O3的混合物中加入足量的稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为7:1时,Fe和
Fe2O3的物质的量之比为( )
A.1:1
B.1:2
C.2:1
D.3:2
参考答案:设原混合物中含有xmolFe,ymolFe2O3,
F
本题解析:
本题难度:一般
5、选择题 下列反应进行分类时,既属于氧化还原反应又属于置换反应的是?????
A.Zn+H2SO4=ZnSO4+H2↑
B.2KClO3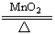 2KCl+3O2↑
2KCl+3O2↑
C.S+O2 SO2
SO2
D.CH4+2O2 CO2+2H2O
CO2+2H2O
参考答案:A
本题解析:
试题分析:A、正确;B、是氧化还原反应,但不是置换反应,错误;C、是氧化还原反应,但不是置换反应,错误;D、是氧化还原反应,但不是置换反应,错 误。
本题难度:一般