微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将等质量的A、B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A的试管中加入少量的CuSO4溶液。如下图表示产生氢气的体积V与时间t的关系,其中正确的是 [???? ]
A.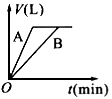
B.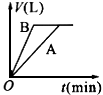
C.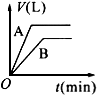
D.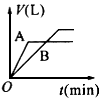
参考答案:D
本题解析:
本题难度:简单
2、选择题 银锌电池广泛用作各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O===2Ag+Zn(OH)2,则负极上发生反应的物质是( )
A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn
参考答案:D
本题解析:负极失电子,对应元素的化合价升高,故为锌。
本题难度:一般
3、填空题 (7分)
(1)冶炼金属常用以下几种方法:①还原法,②电解法,③热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)
Ⅰ.Fe、Zn、Cu 等中等活泼金属 。
等中等活泼金属 。
Ⅱ.Na 、Mg、Al等活泼或较活泼金属 。
、Mg、Al等活泼或较活泼金属 。
Ⅲ.Hg、Ag等不活泼金属 。
(2)写出以锌片、铜片为两极,稀硫酸溶液为电解质溶液组成的原电池的电极反应式:
负极: ;正极: 。
参考答案:
(1)Ⅰ.①,Ⅱ.②,Ⅲ.③(每空1分,共3分)
本题解析:略
本题难度:一般
4、填空题 (14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
元素
| A
| B
| C
| D
|
性质
结构
信息
| 工业上常用电解熔融AD2制取A的单质。
| B的最外层电子数比最内层电子数多1。
| C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。
| D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。
请按要求回答下列问题:
(1)工业上制取A的单质的化学方程式: 。
(2)在25oC、10l kPa下,已知13.5g的B的固体单质在D的气体单质中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是 。
(3)Sn与元素C同主族,周期数比元素C的大2.则Sn的原子序数为 ;配制SnCl2溶液时需用盐酸溶解其晶体,其目的是 。
(4)甲中各原子都满足8电子稳定结构,其电子式为 ;甲溶于水后光照一段时间溶液酸性增强的原因(用离子方程式表示) 。
(5)将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中。写出负极反应的电极方程式 。
参考答案:(1)MgCl2(熔融)电解Mg+Cl2↑ (
本题解析:
试题分析:A、B、C、D为原子序数依次增大的四种第三周期元素,工业上常用电解熔融AD2制取A的单质,说明A应该是活泼的金属镁。B的最外层电子数比最内层电子数多1,因此B的原子序数是13,是铝元素。C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂,则C是硅元素。D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强,该弱酸性物质应该是次氯酸,即D是氯元素。甲的相对分子质量是3×29=87,所以甲是Cl2O。
(1)工业上电解熔融的氯化镁冶炼单质镁,反应的化学方程式为MgCl2(熔融)电解Mg+Cl2↑。
(2)13.5g的铝的物质的量是13.5g÷27g/mol=0.5mol,完全与氯气反应放出419 kJ的热量,因此2mol完全反应放出的热量是419 kJ×4=1676kJ,则反应的热化学方程式为2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol。
(3)Sn与元素硅同主族,周期数比元素硅的大2.则Sn的原子序数为14+18+18=50;+2价的锡在溶液中易水解,因此配制SnCl2溶液时需用盐酸溶解其晶体的目的是抑制SnCl2水解。
(4)甲中各原子都满足8电子稳定结构,这说明氧元素形成2对共用电子对,因此其电子式为 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
(5)镁的金属性强于铝,但与氢氧化钠溶液反应的是铝,而不是镁,所以将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中镁是正极,铝是负极,负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O。
考点:考查元素推断、金属冶炼、热化学方程式、元素周期表的结构、电子式、次氯酸以及原电池原理等
本题难度:困难
5、简答题 天然气(以甲烷计)在工业生产中用途广泛。
Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) 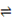 ?CO(g) + 3H2(g)??? ΔH =" +206.2" kJ/mol ?CO(g) + 3H2(g)??? ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g) 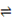 ?CO2(g) +4H2(g)?? ΔH = +165.0kJ/mol ?CO2(g) +4H2(g)?? ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是????????。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率
(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
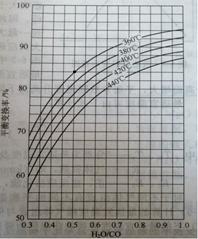
汽气比与CO平衡变换率的关系
析图可知:
① 相同温度时,CO平衡变换率与汽气比的关系是?????。
② 汽气比相同时,CO平衡变换率与温度的关系是?????。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为:Kp=????????。随温度的降低,该平衡常数??????(填“增大”“减小”或“不变”)。
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
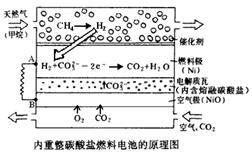
(1)外电路电子流动方向:由??流向???(填字母)。
(2)空气极发生反应的离子方程式是????。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e?转移,有?????g 精铜析出。
参考答案:(12分)
Ⅰ(1)CO(g)+H2O(g)
本题解析:
试题分析:Ⅰ(1)①CH4(g) + H2O(g) 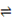 ?CO(g) + 3H2(g)???ΔH1 =" +206.2" kJ/mol ?CO(g) + 3H2(g)???ΔH1 =" +206.2" kJ/mol
②CH4(g) + 2H2O(g)  本题难度:困难 本题难度:困难
|