微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g):△H=-483.6 kJ·mol-1
则N2(g)+3H2(g)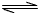 2NH3(g)的△H=_____________。
2NH3(g)的△H=_____________。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:①求5min内的平均反应速率v(NH3)_____________;②达到平衡时NH3的体积分数为_____________。
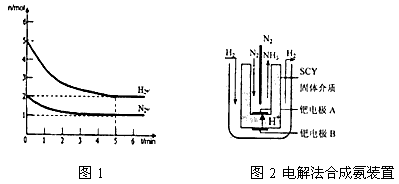
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是______________________________________。
2、选择题 最早使用的化学电源是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-="==" 2MnO(OH)+2OH-
F极:Zn+2NH4Cl -2e-===?Zn(NH3)2Cl2+2H+
总反应式:2MnO2+Zn+2NH4Cl ="==" 2MnO(OH)+Zn(NH3)2Cl2

下列说法正确的是
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
3、选择题 原电池的正极一定是
A.化学性质较活泼的金属
B.化学性质较不活泼的金属
C.电子流出的一极
D.电子流入的一极
4、选择题 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l) = Zn(OH)2(s)+Mn2O3(s),下列说法错误的是[???? ]
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
5、选择题 关于原电池的说法正确的是(????)
A.电流从原电池的负极流向正极
B.电子从发生还原反应的电极流出
C.原电池是将化学能转变为电能的一种装置
D.原电池的两个电极,一定是由活动性不同的两种金属组成