微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (13分)根据下图回答问题:
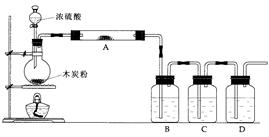
(1)写出浓硫酸和碳粉在加热条件下发生反应的化学方程式:______________________
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是________,作用是 。
B中加入的试剂是________,作用是 。
D中加入的试剂是________,作用是 。
(3)实验时,C中KMnO4溶液发生的变化是
2、选择题 由实验事实得出的结论,其中正确的是
?
| 实验事实
| 结论
|
A
| NH3的水溶液能导电
| NH3是电解质
|
B
| SO2通入硝酸钡溶液出现白色沉淀
| BaSO3不溶于强酸
|
C
| Ca(ClO)2溶液中通入CO2产生白色沉淀
| 酸性:H2CO3 >HClO
|
D
| Na2SiO3溶液中滴入盐酸,产生白色沉淀
| 非金属性:Cl>Si
?
3、实验题 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔沸点数据见下表。
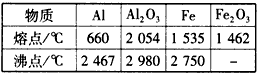
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理_______(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为____________________。
(3)实验室溶解该熔融物,下列试剂中最好的是______ (填序号),并说明理由:____________。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。取一定量该熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
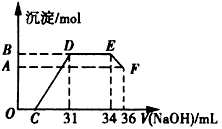
(4)逐滴加入4 mol/L NaOH溶液的定量玻璃仪器是_______ ,图中OC段没有沉淀生成的原因是________(用离子方程式表示)。
(5)由上述图象分析可知,溶液中结合OH-的能力最强的离子是___________(填离子符号,下同),最弱的离子是____________。
(6)若测定F点沉淀的质量,需对混合物进行的处理是:过滤________、________、称量。
(7)用上图数据计算,熔融物中的两种金属的物质的量之比n(Fe):n(Al)=________。
4、选择题 为检验试管中少量白色晶体是否为硫酸铵,下列四位同学分别设计了四种方案,其中可行的方案是
A.加入1 mLNaCl溶液,加热试管,将湿润的红色石蕊试纸靠近试管口
B.加入1 mLNaCl溶液,加热试管,将湿润的蓝色石蕊试纸靠近试管口
C.加入1 mLNaOH溶液,加热试管,将干燥的红色石蕊试纸靠近试管口
D.加入1 mLNaOH溶液,加热试管,将湿润的红色石蕊试纸靠近试管口
5、选择题 下列说法正确的是
A.配制100 mL 1.0 mol/L CuSO4溶液,可将25 g CuSO4·5H20溶于100 mL蒸馏水中
B.将几根火柴头浸于水中,一段时间后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素
C.用纸上层析法分离某些物质时,为了看到色斑,只有有色离子的物质才可以用纸层析法
D.减压过滤时,吸滤瓶内液面高度将达到支管口时,应拔掉吸滤瓶上的橡皮管,并从吸滤瓶支管口倒出溶液
|