微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为证明化学反应有一定的限度,进行如下探究活动:
I.取5 mL 0.1 mol/L的KI溶液,滴加5~6滴稀FeCl3溶液;
Ⅱ.继续加入2 mL CCl4溶液,振荡;
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为_______________ 探究活动Ⅱ的实验现象为________________
(2)探究活动Ⅲ的目的是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+; 猜想二:生成的Fe(SCN)3溶液浓度极小,无法用肉眼观察其颜色。为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中的大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN高。 结合新信息,现设计以下实验方案验证猜想:
①请完成下表:

②写出实验操作“方案一”中反应的离子方程式:_______________。
Ⅳ.为了测定探究活动I中的稀FeCl3溶液的浓度,现进行以下操作:
(3)移取25.00 mL稀FeCl3溶液至锥形瓶中,加入__________作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点时的现象是____________________。
(4)重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则稀FeCl3溶液中溶质的物质的量浓度为_______
mol/L。
参考答案:(1)液体呈棕褐色;溶液分层,下层四氯化碳层呈紫色 (2)①
本题解析:
本题难度:一般
2、实验题 (10分).实验需要0.1 mol/L NaOH溶液450 mL,根据溶液配制中的情况回答下列问题:实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用托盘天平称取?????????????g氢氧化钠固体;
②加水溶解,冷却后将溶液沿玻璃棒注入?????????????;
③用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中;
④继续向容量瓶中加蒸馏水,直到液面接近刻度线????????????cm处;
⑤改用???????????????逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
⑥盖好容量瓶塞,反复颠倒,摇匀;
⑦将配好的溶液倒入试剂瓶中,贴好标签。
(2)配制过程中,下列情况会使配制结果偏高的是???????(填序号)
①定容时俯视刻度线观察液面???????②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④移液后未洗涤烧杯和玻璃棒。
参考答案:(1)? 2.0g? ; 500ml容量瓶 ; 1~2cm;
本题解析:略
本题难度:一般
3、实验题 为比较Fe2+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
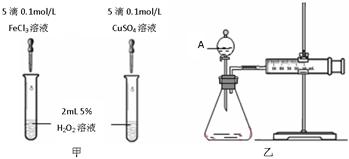
(1)定性分析:如图甲可通过观察???????????????????????????定性比较得出结论,有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是????????????????????????????????。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为??????????????,实验中需要测量的是?????????????????。
(3)某同学要利用乙装置测定某H2O2溶液的物质的量浓度。在锥形瓶中加入0.10 mol MnO2粉末后加入50 mL 该H2O2溶液,在标准状况下放出气体的体积和时间的关系如图所示。
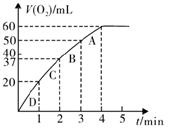
①写出H2O2在MnO2作用下发生反应的化学方程式?????????????????????????????????;
②实验中放出气体的总体积是???????????????mL;
③A、B、C、D各点反应速率快慢的顺序为??????>??????>??????>??????;
④计算H2O2的初始的物质的量浓度??????????????????。(结果保留2位小数)
参考答案:
(1)产生气泡的快慢??消除阴离子不同对实验的干扰
本题解析:略
本题难度:简单
4、选择题 下列实验操作中有错误的是????????????????????????????????
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,温度计水银球应浸没在液体中
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出。
D.用湿润的红色石蕊试纸检验氨气
参考答案:B
本题解析:略
本题难度:简单
5、选择题 某化学兴趣小组欲研究FeCl3.稀H2SO4.KCl.NaCl.Na2CO3.NaOH的性质,对于如何研究,他们设计了两种研究方案:方案①:将它们按照酸.碱.盐分类,然后分别溶于水得到溶液,进行实验;方案②:将它们按照钠盐.钾盐.铁盐与其他化合物分类,然后分别溶于水得到溶液,进行实验.下列说法正确的是( )
A.常温时将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有酸(稀H2SO4)溶液和盐(FeCl3)溶液
B.设计方案②的同学取某溶液,在其中加入上述的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中可能含有Ag+
C.按照方案①的分类,属于碱的有Na2CO3、NaOH
D.这两组同学在研究物质性质时只使用了实验法、观察法
参考答案:A、常温时将少量铜粉分别投入上述溶液中,按照方案①的分类,能
本题解析:
本题难度:简单