微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是? (??? )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
参考答案:B
本题解析:
试题分析:A.放电时,LiMn2O4发生还原反应,错误。B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4。正确。C.充电时,Li2Mn2O4发生氧化反应.错误。D.充电时,阴极反应为:Li++e-=Li。错误。
本题难度:一般
2、选择题 磷酸铁锂电池(LiFePO4,简称LFP)的电池的内部结构如图所示。左边是橄榄石结构的磷酸铁锂材料作为电池的正极,由铝箔与电池正极连接,中间是聚合物的隔膜,它把正极与负极隔开,但锂离子Li+可以通过而电子e-不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接。电池的上下端之间是电池的电解质,电池由金属外壳密闭封装。下列关于电池的说法不正确的
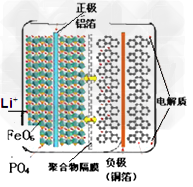 [???? ]
[???? ]
A. LFP电池在充电时,正极中的锂离子Li+通过聚合物隔膜向负极迁移
B. LFP电池放电时,锂离子从负极中脱出来,经过电解液,穿过隔膜回到正极材料中
C. 负极反应:C6Li-xe-==C6Li(1-x)+xLi+?(C6Li表示锂原子嵌入石墨形成复合材料)
D.?正极反应:Li(1-x)FePO4?+?xLi+??==?Li+?x?e-+FePO4??(LiMO2表示含锂的过渡金属氧化物?)???
参考答案:D
本题解析:
本题难度:一般
3、填空题 (3分) 对于反应2A(g)+B(g) 2C(g)+Q (Q>0),下列图象正确的是???????
2C(g)+Q (Q>0),下列图象正确的是???????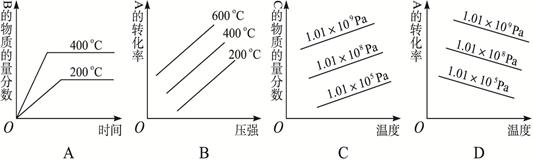
参考答案:AD
本题解析:略
本题难度:一般
4、简答题 现有如下两个反应:(A)NaOH+HCl=NaCl+H2O? (B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池______
(2)如果不能,说明其原因______
(3)如果可以,请写出正负极材料名称和电极反应式.
______是正极,正极反应式:______
______是负极,负极反应式:______.
参考答案:(1)原电池是将化学能转变为电能的装置,只有氧化还原反应才有
本题解析:
本题难度:一般
5、填空题 (18分)氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为: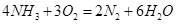 。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
a.电能全部转化为化学能
b.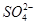 的物质的量浓度不变(不考虑溶液体积变化)
的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液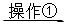 白色沉淀
白色沉淀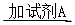 观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu。写出装置中阳极的电极反应式__________。
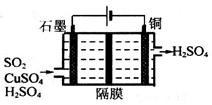
(3)已知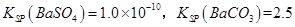
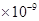 。某同学设想用下列流程得到BaCl2,
。某同学设想用下列流程得到BaCl2,
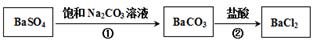
则①的离子方程式为_________,该反应的平衡常数K=__________;
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液,发生 反应
反应
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:
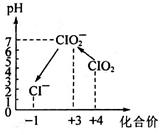
请回答:
①确定操作Ⅱ完全反应的现象是___________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________。
参考答案:(1)2NH3-6e-+6OH-=N2+6H2O;bd。(2
本题解析:
试题分析:(1)氨气燃料电池中氨气中的氮元素化合价升高,在负极反应,所以负极的电极反应为:2NH3-6e-+6OH-=N2+6H2O;a电解装置不可能将电能全部转化为化学能,还有热能,错误;b硫酸根离子在电解精炼中没有反应,不变,正确;c铜离子向阴极移动,错误;d阳极上比铜活波的金属反应,比铜不活波的金属会作为阳极泥落下来,正确;e阳极是铝、锌等先反应,所以阳极质量减少了64克,不是铜减少了64克,不能计算转移电子数,错误。所以选bd。(2)①所得的悬浊液经过过滤得到白色沉淀,在加入盐酸看沉淀是否溶解,若未溶解,说明反应过程中二氧化硫被氧气氧化成了硫酸根离子,所以反应的离子方程式为:2SO2+2Ba2++O2+2H2O=2BaSO4+4H+。②若用电解法吸收尾气中的二氧化硫,则二氧化硫在阳极失去电子变成硫酸根离子,电极反应为:SO2+2H2O-2e-=4H++SO42-(3)因为Ksp(BaSO4)<Ksp(BaCO3),所以硫酸钡可以转变成碳酸钡,BaSO4(s)+CO32-(aqs)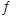 BaCO3(s)+SO42-(aq),其平衡常数等于Ksp(BaSO4)/<Ksp(BaCO3)=0.04。(4)①操作Ⅱ使碘单质反应,所以完全反应的现象为溶液蓝色褪去。②pH至1~3,溶液中的离子从ClO2-变成Cl-,氯元素的化合价降低,所以碘元素的化合价升高,从-1价的碘离子变成碘单质,溶液又显蓝色。ClO2-+4I-+4H+=Cl-+2I2+2H2O
BaCO3(s)+SO42-(aq),其平衡常数等于Ksp(BaSO4)/<Ksp(BaCO3)=0.04。(4)①操作Ⅱ使碘单质反应,所以完全反应的现象为溶液蓝色褪去。②pH至1~3,溶液中的离子从ClO2-变成Cl-,氯元素的化合价降低,所以碘元素的化合价升高,从-1价的碘离子变成碘单质,溶液又显蓝色。ClO2-+4I-+4H+=Cl-+2I2+2H2O
考点:电解精炼,难溶电解质的转化,氧化还原反应
本题难度:困难