微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (18分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为:??????????????????????????????????????????。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:

(2)氢氧燃料电池中,a电极为电池的是??????(填“正极”或“负极”),气体M的分子式????????,a电极上发生的电极反应式为:????????????????????????????。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为????????mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是????????。
① N2、H2、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
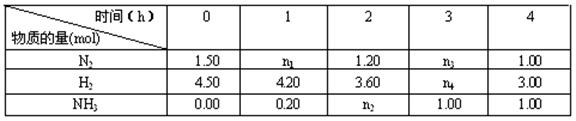
根据表中数据计算:
①反应进行到2小时时放出的热量为??????kJ。
②0~1小时内N2的平均反应速率???????mol·L-1·h-1。
③此条件下该反应的化学平衡常数K==????????????(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1 mol,化学平衡向???方向移动(填“正反应”或“逆反应”或“不移动”。)
参考答案:(18分)(1) H2(g)+1/2O2(g)=H2O(l)
本题解析:略
本题难度:简单
2、计算题 (7分)一定温度下,物质的量浓度分别为2mol/L和1.5mol/L的SO2(g)和O2(g)在密闭容器中发生反应:2SO2(g)+ O2(g) 2SO3(g),4min后反应达到平衡状态,测得容器中SO2(g)的转化率为60%,试求,在该温度下:
2SO3(g),4min后反应达到平衡状态,测得容器中SO2(g)的转化率为60%,试求,在该温度下:
(1)用SO2表示的平均反应速率;
(2)平衡时O2的转化率;
(3)此反应的平衡常数。
参考答案:
本题解析:(共7分)由题可知,SO2的变化浓度为2mol·L-1×60%=1.2mol·L-1,则O2和SO3的变化浓度分别为0.6mol·L-1和1.2mol·L-1,则:
2SO2(g) +? O2(g)  2SO3(g)
2SO3(g)
起始时各物质浓度/mol·L-1??? 2??????? 1.5???????? 0
本题难度:一般
3、选择题 在一定温度下,某体积不变的密闭容器中发生如下可逆反应:A2(g)+B2(g)=2AB(g);该反应到达平衡状态的标志是( )
A.用A2、B2、AB的物质的量浓度表示反应速率的比值为1:1:2
B.容器内的总压强不随时间变化而变化
C.单位时间内生成2nmolAB的同时生成nmolB2
D.容器内混合气体的平均相对分子质量保持不变
参考答案:A.无论反应是否达到平衡状态,都存在化学反应速率之比等于化学
本题解析:
本题难度:一般
4、选择题 某温度下,密闭容器中发生反应aX(g) 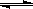 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是???
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是???
A.可逆反应的化学计量数数:a>b+c
B.压缩容器的容积时,v正增大,v逆减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
参考答案:C
本题解析:恒温下,体积缩小为原来的一半,假设原反应的平衡不移动,则物质Y和Z的浓度将均增加至原来的2倍,而实际上Y、Z的浓度均为原来的1.8倍,说明平衡向逆反应方向移动,因而X的转化率减小,Z的质量分数减小。因体积减小(即压强增大),正、逆反应速率均增大,且化学平衡是向着气体物质的物质的量减少的方向移动,有a<b+c。[点拨]如果已知压强改变后浓度变化情况,可先看平衡不移动时压强改变后浓度应该变化, 再由实际情况即可确定压强对平衡的影响。
本题难度:简单
5、填空题 甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和II,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) 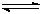 ?CO(g)+3H2 (g)……I?? CO(g)+2H2(g)?
?CO(g)+3H2 (g)……I?? CO(g)+2H2(g)?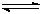 CH3OH(g) ……II。
CH3OH(g) ……II。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。
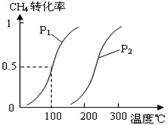
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____________________。
②图中的P1_________P2(填“<”、“>”或“=”),100℃时平衡常数的值为__________?。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a?mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H?____?0;若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
④为了寻找合成甲醇的温度和压强的适宜条件,某同学设计三组实验,部分实验条件已经填在下面实验设计表中。
实验编号
| T(℃)
| N(CO)/n(H2)
| P(Mpa)
|
i
| 150
| 1/3
| 0.1
|
ii
| ?
| ?
| 5
|
iii
| 350
| ?
| 5
?
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应II的特点,在给出的坐标图中,画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
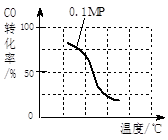
参考答案:(1)①0.003mol/(L·min)(2分)???②&l
本题解析:
试题分析:⑴①0.003mol/(L·min)???②<2.25×10-4????⑵③反应Ⅱ为熵减的反应,要自发反应必须为放热反应,故△H?<?0,若容器容积不变,可增加甲醇产率的措施有BD。④a通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,由此可得:Ⅱ中温度为150℃,n?(CO)/n(H2)=1/3,Ⅲ中n?(CO)/n(H2)为1/3;
本题难度:困难
|