微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)工业上合成甲醇一般采用下列反应: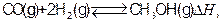 下表是该反应在不同温度下的化学平衡常数(K):
下表是该反应在不同温度下的化学平衡常数(K):

(1)由表中数据判断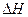 0(填“>”、“=”或“<”)。
0(填“>”、“=”或“<”)。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为 ℃。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:

①反应从2min到4min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2min时改变了反应条件,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压 下:
下:
①
②
③
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳。该电池的负极反应式为: 。
若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为 L。
参考答案:(12分)
(1)<(1分) &
本题解析:略
本题难度:一般
2、选择题 已知在一定条件下,CH4与NO2存在以下可逆反应:CH4(g)+4NO2(g)?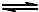 ?4NO(g)+CO2(g)+2H2O(g);△H=-x?
?4NO(g)+CO2(g)+2H2O(g);△H=-x?
kJ/mol,现取12mol?CH4与NO2的混合物在该条件下反应至平衡时,共转移电子16mol,并放出热量1148kJ,则该反应中的x值及12mol混合气体中CH4与NO2的物质的量之比为
A.x=1148,
B.x=574,
C.x=574,
D.x=574,
参考答案:D
本题解析:分析:反应中甲烷是还原剂,二氧化氮是氧化剂,甲烷中碳元素由-4价升高为+4价,根据电子转移可知,参加反应甲烷的物质的量为2mol,放出热量1148kJ,所以2x=1148,故x=574;
由于反应为可逆反应,所以混合气体中甲烷的物质的量大于2mol,由于有2mol的甲烷反应,所以二氧化氮的物质的量至少由8mol,据此判断合气体中CH4与NO2的物质的量之比.
解答:反应中甲烷是还原剂,二氧化氮是氧化剂,甲烷中碳元素由-4价升高为+4价,令参加反应的甲烷为ymol,根据电子转移可知,8y=16,解得y=2,所以参加反应甲烷的物质的量为2mol,放出热量1148kJ,所以2x=1148,故x=574;
由于反应为可逆反应,所以混合气体中甲烷的物质的量大于2mol,由于有2mol的甲烷反应,所以二氧化氮的物质的量至少由8mol,即甲烷的物质的量2mol<n(CH4)<12mol-8mol=4mol,8mol<n(NO2)<12mol-2mol=10mol.
所以混合气体中CH4与NO2的物质的量之比 <
< <
<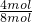 ,即
,即 <
< <
< .
.
故选:D.
点评:考查氧化还原反应的计算,难度中等,注意反应为可逆反应,根据可逆反应的特点判断甲烷与二氧化氮的范围是关键.
本题难度:困难
3、选择题 下列说法不正确的是
A.化学反应中的能量可能以热能的形式表现出来
B.化学反应的热效应数值与参加反应的物质多少有关
C.放热反应不一定需要加热
D.焓变是指1 mol物质参加反应时的能量变化
参考答案:D
本题解析:
试题分析:A、化学反应中能量主要以热能形式表现出来,也可能以光能、电能等形式表现出来,正确;B、参加反应物质的物质的量不同,产生的热效应是不同的,因此化学反应的热效应数值与参加反应的物质多少有关,正确;C、常见的放热反应:可燃物的燃烧,酸碱中和反应,大多数化合反应,置换反应,有的需要加热如碳的燃烧,目的达到燃烧温度,有的不需要加热,如酸碱中和反应,因此放热反应不一定需要加热,正确;D、焓变是在恒温、恒压条件下,化学反应过程中所吸收或释放的能量,不是指1mol物质参加反应时的能量变化,错误。
考点:考查化学反应中的能量变化。
本题难度:一般
4、选择题 某溶液中可能含有Mg2+、Al3+、SO42-、I-,分别取样进行如下实验:
①加入氯水时,溶液呈黄色,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀;
②加入过量的NaOH溶液,产生白色沉淀.
则下列离子中不能确定其是否存在的是
A.Mg2+
B.Al3+
C.SO42-
D.I-
参考答案:B
本题解析:分析:①加入氯水时,溶液呈黄色,证明有单质碘出现,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,可以是硫酸钡沉淀;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁,证明含有镁离子.
解答:①加入氯水时,溶液呈黄色,证明含有碘离子,碘离子被氯气氧化为碘单质,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,只能是硫酸钡沉淀,证明含有硫酸根离子;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁沉淀,一定会含有镁离子,可能含有铝离子,因为生成的氢氧化铝可以溶于过量的氢氧化钠中.
所以离子中不能确定其是否存在的是铝离子.
故选B.
点评:本题主要考查了根据实验现象判断离子共存,要掌握根据实验现象判断存在的离子,排除与该离子反应的离子.
本题难度:一般
5、实验题 (15分)I.(9分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
实验方案
| 实验现象
|
①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞
| (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色
|
②向新制的H2S饱和溶液中滴加新制的氯水
| (B)产生气体,可在空气中燃烧,溶液变成浅红色
|
③钠与滴有酚酞试液的冷水反应
| (C)反应不十分强烈,产生的气体可以在空气中燃烧
|
④镁带与2 mol·L-1的盐酸反应
| (D)剧烈反应,产生可燃性气体
|
⑤铝条与2 mol·L-1的盐酸反应
| (E) 生成淡黄色沉淀
请你帮助该同学整理并完成实验报告:
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律。
(2)实验用品:
仪器:①试管 ②酒精灯 ③胶头滴管 ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸 ⑨烧杯等。
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、饱和的H2S溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
① ② ③ ④ ⑤ (用A-E表示)
写出③的离子方程式 。
(4)实验结论: 。
II. (6分)实验室利用如图装置进行中和热的测定,请回答下列问题:
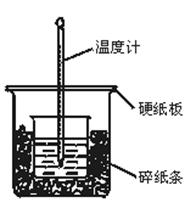
(1)从实验装置上看,图中尚缺少一种玻璃仪器是 。
(2)做1次完整的中和热测定实验,温度计需使用 次。
(3)某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?
参考答案:I.(9分)
(3)① B ②
本题解析:I中通过实验考查了元素周期律相关知识,主要是第三周期元素单质的金属性及非金属的强弱比较。II是关于中和热实验的测定,实验的关键是减小热量损失,减少实验误差。
本题难度:困难
|