微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列各组离子在指定溶液中能大量共存的是
A.澄清的溶液中:Na+、K+、Mn、Al
B.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、C
C.=1014的溶液中:S、N、N、K+
D.c(I-)=0.1?mol?L-1的溶液中:Na+、H+、ClO-、S
参考答案:A
本题解析:分析:A.该组离子之间不反应;
B.滴入酚酞呈无色的溶液,显碱性;
C.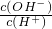 =1014的溶液,c(OH-)=1mol?L-1,溶液显碱性;
=1014的溶液,c(OH-)=1mol?L-1,溶液显碱性;
D.离子之间发生氧化还原反应.
解答:A.该组离子之间不反应,能大量共存,故A正确;
B.滴入酚酞呈无色的溶液,显碱性,Al3+、OH-结合生成沉淀,Al3+、CO32-相互促进水解,则不能共存,故B错误;
C.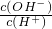 =1014的溶液,c(OH-)=1mol?L-1,溶液显碱性,NH4+、OH-结合生成弱电解质,则不能共存,故C错误;
=1014的溶液,c(OH-)=1mol?L-1,溶液显碱性,NH4+、OH-结合生成弱电解质,则不能共存,故C错误;
D.I-、H+、ClO-离子之间发生氧化还原反应,则不能共存,故D错误;
故选A.
点评:本题考查离子的共存,明确习题中的信息是解答的关键,并熟悉常见离子之间的反应来解答,选项B中的相互促进水解及选项D中的氧化还原反应为解答的易错点,题目难度不大.
本题难度:一般
2、选择题 制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应:2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁
B.烧杯中有铁无铜
C.烧杯中铁、铜都有
D.烧杯中铁、铜都无
参考答案:B
本题解析:向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,由于Fe的还原性比Cu强,Fe3+首先应与Fe反应,如果Fe3+有剩余,剩余的Fe3+再与Cu反应。铁粉未反应完时铜粉就不会被氧化,所以不可能出现烧杯中有铁无铜的现象,故应选B。其他三个选项的情况都可能再现。当FeCl3过量或恰好完全反应时,Fe、Cu均无剩余,即选项D,反应后溶液中有Fe3+、Fe2+、Cu2+或Fe2+、Cu2+。当FeCl3不足量时,有两种情况:①Fe粉有剩余,则Cu尚未参加反应,即选项C,反应后溶液中只有Fe2+(不考虑H+、OH-);②铁粉无剩余,则Cu反应了一部分或尚未参加反应,即选项A,反应后溶液中有Fe2+、Cu2+或只有Fe2+。
本题难度:一般
3、选择题 铁或铝能在冷的浓硝酸中发生“钝化”,这是利用浓硝酸的
A.强酸性
B.强氧化性
C.不稳定性
D.挥发性
参考答案:B
本题解析:“钝化”是利用浓硝酸的强氧化性,把金属表面氧化成致密的氧化物保护膜。
本题难度:简单
4、选择题 加热某NaHCO3和Na2CO3·xH2O的混合物40 g,到不再产生气体为止,得残留固体21.2 g.把加热过程中产生的气体全部通入含有0.05 molBa(OH)2的溶液中,恰好使生成的沉淀完全消失,则x为
A.6
B.7
C.9
D.10
参考答案:B
本题解析:因加热固体混合物,所得气体通过含有0.05 molBa(OH)2的溶液中, 恰好使生成的沉淀完全消失,所以可得2CO2~Ba(OH)2,所以n(CO2)=0.1 mol,又CO2由NaHCO3加热分解得到,所以NaHCO3加热分解时,固体质量的减少量为6.2 g,同时产生Na2CO3的物质的量为0.1 mol;而固体混合物的总质量减少了18.8 g,则由Na2CO3·xH2O失水减少的质量为12.4 g,同时残留固体为21.2 g,说明加热后产生的n(Na2CO3)=0.2 mol,则原Na2CO3·xH2O的物质的量为0.1 mol,由此得x=7.
本题难度:困难
5、选择题 将1 molNH3和2 molO2混和,在800℃铂催化剂作用下充分反应,当恢复到常温常压时,所得的最终产物是H2O和
A.NO
B.NO2
C.HNO3
D.NO、HNO3
参考答案:C
本题解析:
本题难度:一般