23.5℃
已知:Q=cm(t2 -t1),反应后溶液的比热容c为4.18J·℃-1· g-1,各物质的密度均为1g·cm-3。
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式(△H值精确到小数点后2位):
???????????????????????????????????????????????????????????????????????(4)若用KOH代替NaOH,对测定结果??????(填“有”或“无”)影响。
参考答案:(13分)
(1)量筒??温度计(4分)
(2)
本题解析:
试题分析:实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是量筒??温度计;实验中不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝导热性良好,会对中和热的计算造成影响;已知:Q=cm(t2 -t1),反应后溶液的比热容c为4.18J·℃-1· g-1,各物质的密度均为1g·cm-3;NaOH溶液与HCl溶液反应的热化学方程式是NaOH(aq)+HCl(aq)=NaCl(aq)+
本题难度:一般
2、选择题 下列说法或表示正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由单质A转化为单质B,△H=+119kJ/mol,可知单质B比单质A稳定
C.稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)H=-571.6kJ/mol
参考答案:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧
本题解析:
本题难度:一般
3、选择题 已知热化学方程式C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256kJ/mol
B.若转移10mol电子,则消耗2.5molO2
C.若生成2mol液态水,则△H=-2512kJ/mol
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
参考答案:B
本题解析:
正确答案:B
A、不正确,水不是液态;B正确;C、不正确,本题给的是气态水;D、不正确,1molCO2形成4mol共用电子对,放出的热量为628kJ
本题难度:一般
4、选择题 标准状态下,气态分子断开l mol化学键的焓变称为键焓。已知H-H、H-O和O-O键的键焓ΔH分别为436 kJ/mol、463 kJ/mol和495kJ/mol。下列热化学方程式正确的是
A.H2O (g)= H2(g)+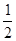 O2(g); ΔH=" -485" kJ/mol O2(g); ΔH=" -485" kJ/mol
B.H2O (g)=H2(g)+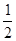 O2(g); ΔH="=+485" kJ/mol O2(g); ΔH="=+485" kJ/mol
C.2H2(g)+ O2 (g)= 2H2O(g) ΔH =" +485" kJ/mol
D.2H2(g)+ O 2(g)=2H2O(g) ΔH =" -485" kJ/mol
参考答案:D
本题解析:
试题分析: 1mol的气态水分解产生1mol的氢气和1/2mol的氧气的能量变化是:2×463 kJ-436-1/2×495="242." 5.因此热化学方程式为H2O (g)= H2(g)+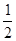 O2(g);? ΔH=" +242." 5kJ/mol。A.B错误。则若是2mol的气态水分解产生2mol的氢气 O2(g);? ΔH=" +242." 5kJ/mol。A.B错误。则若是2mol的气态水分解产生2mol的氢气
本题难度:一般
5、选择题 已知强酸与强碱在稀溶液里反应的中和热可表示为:
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,对下列反应:
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ/mol[
H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ/mol
HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)?? ΔH=-Q3 kJ/mol
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是
A.Q2>Q3>Q1
B.Q2>Q1>Q3
C.Q1=Q2=Q3
D.Q2=Q3>Q1
参考答案:A
本题解析:CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) 为弱酸与强碱反应,弱酸电离出H+时要吸热热量,所以该反应放出热量较57.3 kJ少;H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) 反应中,浓硫酸稀释会热,其能量最终释放的最多,即大于57.3 kJ;HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)属于强酸与强碱反应,释放的热量为57.3 kJ;
所以,其关系为:Q2>Q3>
本题难度:一般
|