微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,等物质的量的下列物质分别与足量的浓盐酸反应,产生Cl2的物质的量最多的是
A.MnO2
B.KClO3
C.KMnO4
D.Ca(ClO)2
参考答案:B
本题解析:
试题分析:4种物质与足量浓盐酸反应的离子方程式分别为2Cl- + 4H+ + MnO2 Mn2+ + Cl2↑+ 2H2O、ClO3-+6H++5Cl-
Mn2+ + Cl2↑+ 2H2O、ClO3-+6H++5Cl- 3Cl2↑+3H2O、2MnO4-+16H++10Cl-
3Cl2↑+3H2O、2MnO4-+16H++10Cl- 2Mn2++5Cl2↑+8H2O、ClO-+2H++Cl-
2Mn2++5Cl2↑+8H2O、ClO-+2H++Cl- Cl2↑+H2O。1molMnO2、KClO3、KMnO4、Ca(ClO)2与足量的浓盐酸反应,产生Cl2的物质的量分别为1mol、3mol、2.5mol和2mol,最多的是KClO3,选B。
Cl2↑+H2O。1molMnO2、KClO3、KMnO4、Ca(ClO)2与足量的浓盐酸反应,产生Cl2的物质的量分别为1mol、3mol、2.5mol和2mol,最多的是KClO3,选B。
考点:考查氧化还原反应的相关计算。
本题难度:一般
2、选择题 足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是
A.参加反应的硝酸是0.4mol
B.消耗氧气的体积为1.68 L
C.此反应过程中转移的电子为0.3 mol
D.混合气体中含NO21.12 L
参考答案:D
本题解析:
试题分析:二氧化氮和一氧化氮为0.1摩尔,消耗硝酸0.1摩尔,氢氧化钠为0.2摩尔,所以硝酸铜0.1摩尔,转移电子数为0.2摩尔,则硝酸铜中的硝酸根离子0.2摩尔,总共硝酸的物质的量为0.3摩尔,根据电子守恒,铜失去的电子间接转移给氧气,所以需要氧气的物质的量为0.05摩尔,体积为1.12升;假设二氧化氮为x摩尔,,一氧化氮为y摩尔,则有x+y=0.1(二氧化氮和一氧化氮的物质的量),x+3y=0.2(转移电子守恒),解x=y=0.05mol,则二氧化氮的体积为1.12升,选D。
考点:硝酸的性质,电子守恒的计算。
本题难度:一般
3、选择题 下列电子式中错误的是(??)
A.Na+
B.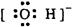
C.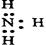
D.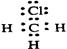
参考答案:C
本题解析:
试题分析:A.Na原子失去最外层电子,次外层变为最外层,因此Na+离子的电子式是 Na+。正确。B.O原子最外层有6个电子,与H原子形成一对共用电子对,又从外界获得一个电子,O原子的最外层得到8电子的稳定结构,作为整体带一个单位的负电荷。正确。 C.N原子最外层有5个电子,与3个H原子形成三对共用电子对,达到最外层8个电子的稳定结构,因此NH3的电子式是 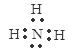
本题难度:简单
4、选择题 黑火药是我国历史上的四大发明之一,它的成分是硝酸钾、炭粉和硫粉的混合物,点火爆炸后的产物是二氧化碳、硫化钾和氮气。在该反应中被还原的元素为 ??(??? )
A.S
B.C
C.N
D.S和N
参考答案:D
本题解析:
正确答案:D
2KNO3+S+3C=K2S+3CO2+N2, S降为-2价和N降为0价,被还原,D正确。
本题难度:一般
5、选择题 密度为0.91 g·cm-3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度
A.等于12.5%
B.大于12.5%
C.小于12.5%
D.无法确定
参考答案:C
本题解析:
【错解分析】错选 ①A,②B。出现①误区,是由于当假设加入与氨水等质量的水,进行稀释后,可推导出溶液的质量增加一倍,氨水的质量百分比浓度为12.5%,于是就匆匆忙忙选取①为答案。完全违背了原来“巧解”的意愿,造成了失误。由此可见,稍有疏忽,就会半途而废,望大家引以为戒。出现②误区,是由于思维定势的干扰。
【正解】本题的突破口在“该氨水用等体积的水稀释”。我们可以假设加入与氨水等质量的水,进行稀释,这时溶液的质量增加一倍,所以氨水的质量分数应该变为原来的一半,即为12.5%。但题目所给的是加入
本题难度:一般