微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关电化学的示意图正确的是( )
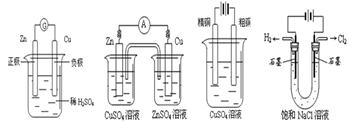
A B C (电解精炼铜) D
参考答案:D
本题解析:
试题分析:A中Zn为负极,Cu为正极。B中两个半电池应该是Zn—ZnSO4、Cu—CuSO4。C中电解精炼铜粗铜为阳极,精铜为阴极。
考点:电化学知识
点评:考查电化学的示意图,难度一般,解题的技术是要认清原电池和电解池,正负极材料的选择。
本题难度:简单
2、选择题 ①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④
B.①③④②
C.③④②①
D.③①②④
参考答案:B
本题解析:由原电池原理判断金属活动性,外电路电流从②流向①,②为正极,金属活动性①>②;①③相连,③为正极,金属活动性①>③;②④相连,②上有气泡(H2)逸出,②为正极,金属活动性④>②;③④相连,③质量减少,则金属活动性③>④,即金属活动性顺序为①>③>④>②,B正确。
本题难度:一般
3、填空题 (15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
氢氧化物
| Cu(OH)2
| Fe(OH)3
| Fe(OH)2
| Mg(OH)2
|
Ksp
| 2.2×10-20
| 4.0×10-38
| 8.0×10-16
| 1.8×10-11
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示)。
(2)实验室制备氨气的化学方程式为 。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为 。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
温度(K)
| 平衡时NH3的物质的量(mol)
| T1
| 2.4
| T2
| 2.0
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。若再增加氢气浓度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

参考答案:(1)Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(
本题解析:
试题分析:(1)溶度积常数越小,越溶液产生沉淀,根据溶度积常数大小可知产生沉淀的先后顺序是Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2。
(2)实验室利用熟石灰与氯化铵加热制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2  CaCl2+2NH3↑+2H2O;原电池中负极失去电子发生氧化反应,因此氨气在负极通入,失去电子转化为肼,所以该电池的负极反应为2NH3+2OH--2e-=N2H4+2H2O。 CaCl2+2NH3↑+2H2O;原电池中负极失去电子发生氧化反应,因此氨气在负极通入,失去电子转化为肼,所以该电池的负极反应为2NH3+2OH--2e-=N2H4+2H2O。
(3)①已知破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量,这说明该反应是放热反应。根据表中数据可知T1时生成的氨气多,温度低有利于氨气的生成,所以T1<T2。
②平衡时氨气的物质的量是2mol,则根据方程式N2+3H2 2NH3可知消耗氢气的物质的量是3mol,浓度是1mol/L,所以0~10min内H2的平均速率v(H2)=1mol/L÷10min=0.1 mol?L-1?min-1 ;消耗氮气的物质的量是1mol,所以氮气的转化率是 2NH3可知消耗氢气的物质的量是3mol,浓度是1mol/L,所以0~10min内H2的平均速率v(H2)=1mol/L÷10min=0.1 mol?L-1?min-1 ;消耗氮气的物质的量是1mol,所以氮气的转化率是 ;平衡常数只与温度有关系,因此若再增加氢气浓度,该反应的平衡常数将不变。 ;平衡常数只与温度有关系,因此若再增加氢气浓度,该反应的平衡常数将不变。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A、对于具体的化学方程式反应热是不变,因此反应热不变不能表明该可逆反应达到平衡状态,A错误;B、混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以当平均相对分子质量不再发生变化时,能表明该可逆反应达到平衡状态,B正确;C、当氮气含量不再发生变化时,可以说明反应达到平衡状态,C正确;D、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即密度始终是不变,D错误,答案选BC。
考点:考查溶度积常数应用、氨气制备、电极反应式书写、化学平衡状态的判断、计算等
本题难度:困难
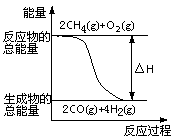
4、选择题 甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71 kJ/mol
②CO(g)+2H2( g)=CH3OH(l) △H=-90.5 kJ/mol
下列说法不正确的是 [???? ]
A.CO(g)+2H2(g)=CH3OH(g) △H>-90.5 kJ/mol
B.在甲醇燃料电池中,甲醇所在的电极为正极
C. CH4(g)+1/2O2(g)=CH3OH(l) △H=-126kJ.mol-1
D.反应①中的能量变化如下图所示
参考答案:B
本题解析:
本题难度:一般
5、选择题 用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为(???????)
A.1mol/L
B.2mol/L
C.3mol/L
D.4mol/L
参考答案:A
本题解析:分析:根据电解池中离子的放电顺序和两极上发生的变化来书写电极反应方程式,并且两个电极上转移的电子数目是相等的,溶液中遵循电荷守恒.
解答:解:电解0.1LH2SO4和CuSO4的混合溶液,阳极发生的反应为:4OH-→2H2O+O2↑+4e-,阴极上发生的电极反应为:Cu2++2e-→Cu,2H++2e-→H2↑,
两极均收集到2.24L(标况)气体,即均生成0.1mol的气体,阳极生成0.1mol氧气说明转移了0.4mol电子,而阴极上生成的0.1molH2只得到了0.2mol电子,
所
本题难度:一般
|
|