微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是
A.二氧化硫的排放会造成温室效应
B.绿色食品是不含任何化学物质的食品
C.利用丁达尔效应可区分溶液与胶体
D.用加热的方法不能鉴别NaHCO3和Na2CO3
参考答案:C
本题解析:分析:A.造成温室效应的气体是二氧化碳;
B.绿色食品指的是安全、无公害的食品;
C.胶体有丁达尔效应,溶液没有;
D.碳酸氢钠不稳定加热易分解.
解答:A.造成温室效应的气体是二氧化碳,二氧化硫是形成酸雨的主要成分,故A错误;
B.绿色食品指的是安全、无公害的食品,任何物质都是由化学物质构成的,故B错误;
C.胶体有丁达尔效应,溶液没有,故利用丁达尔效应可以区分溶液和胶体,故C正确;
D.碳酸氢钠不稳定加热易分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解,所以可以用加热方法鉴别,故D错误;
故选C.
点评:本题考查较综合,但较基础,知道形成酸雨的成分、胶体的性质,这些都是常考查点,难度不大.
本题难度:一般
2、简答题 氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(1)精制过程中反应的离子方程式为______.
(2)电解过程的总反应方程式为______.
(3)电解槽阳极产物可用于______(至少写出两种用途).
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100
NaOH/g
109
118
129
146
177
300
313
318
337
NaCl/g
36
36.3
36.6
37
37.3
37.8
38.4
39
39.8
根据上述数据,脱盐的主要工序应为______、______.脱盐后的碱液含NaOH约50%,含NaCl仅约2%左右,NaCl能够从溶液中大量析出的原因是______.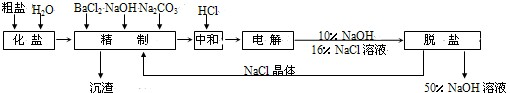
参考答案:(1)精制过程中,加入氯化钡,可以将杂质离子硫酸根除去,即B
本题解析:
本题难度:一般
3、选择题 在下列条件的城市中,最适宜建硫酸厂的是
A.甲城市需使用硫酸的工厂较多,郊区有丰富的黄铁矿资源,水源、能源也充足.
B.乙城市是一风光秀丽、空气清新的旅游城市.
C.丙城市有丰富的磷灰石,拟建一座大型磷肥厂.
D.丁城市需使用硫酸的工厂不多,却有丰富的黄铁矿资源,水源、能源也充足.
参考答案:A
本题解析:
本题难度:一般
4、填空题 使用Cl2对自来水消毒时,会产生对人体有害的有机氯化物,而二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
(1)Cl2可以通过氯碱工业获得.氯碱工业中电解饱和食盐水的化学方程式为______,电解一段时间后,欲使溶液恢复到电解前的浓度和体积,可向电解后的溶液中加入(或通入)______.用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.除杂操作时,往粗盐水中先加入过量的______(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.
(2)氯化钠电解法是一种可靠的工业生产ClO2的方法.该法工艺原理示意如图.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.氯化钠电解槽中发生反应的化学方程式为______,发生器中生成ClO2的化学方程式为______.

参考答案:(1)氯碱工业中电解饱和食盐水的化学方程式为:2NaCl+2
本题解析:
本题难度:一般
5、选择题 中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠或镁的制备。下列关于这三个工业生产的描述中正确的是[???? ]
A.电解法制镁时一般是用熔融态的氯化镁进行电解,但也可用其相应的盐,如熔融态的碳酸镁
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子
参考答案:B
本题解析:
本题难度:一般
|