微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是????????????????????????????????????????????????????????????????????????????????????????????(???)
A.向次氯酸钙溶液中通入SO2:Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰使SO2-4沉淀完全
NH+4+Al3++2Ba2++2SO2-4+4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓
C.硫化铜固体中加入硫酸锌稀溶液[已知
Ksp(CuS)<Ksp(ZnS)]:CuS+Zn2+==ZnS+Cu2+
D.向硝酸银溶液中滴加稀氨水至过量:
AgNO3+NH3·H2O==AgOH+NH4NO3
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列反应的离子方程式书写正确的是( )
A.金属铝溶于氢氧化钠溶液Al+20H-=AlO2-+H2↑
B.钠和水反应??Na+2H20=Na++20H-+H2↑
C.金属铝溶于稀硫酸中:2Al+6H+=2A13++3H2↑
D.铜粉加入FeCl3溶液中:Cu+Fe3+=Fe2++Cu2+
参考答案:A.金属铝溶于氢氧化钠溶液的离子反应为2Al+2H2O+20
本题解析:
本题难度:简单
3、选择题 已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,
FeS>H2S>CuS,则下列离子方程式错误的是 [???? ]
A.Mg2+ +HCO3-+2Ca2+ +4OH- ==Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S==CuS↓+2H+
C.Zn2++S2-+2H2O==Zn(OH)2↓+H2S↑
D.FeS+2H+==Fe2++H2S↑
参考答案:C
本题解析:
本题难度:一般
4、填空题 硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如下:
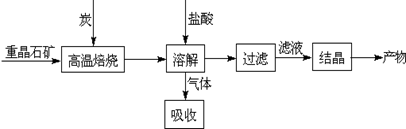
某研究小组查阅资料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1??????①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1??????①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1????? ②
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1????? ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是?????????。
(2)反应C(s)+CO2(g) 2CO(g)的△H= ??????????。
2CO(g)的△H= ??????????。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,???????????????????????????;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图所示。

该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是???(填序号)。
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2═2H2O。

请回答:
(5)H+由???极通过固体酸电解质传递到另一极(填a或者b)。
(6)b极上发生的电极反应是 ?????????????????。
参考答案:27.(12分,每空2分)
Ⅰ.(1)H2S+2OH-
本题解析:
试题分析:
Ⅰ.(1)吸收的气体是H2S,得到硫化钠。该反应的离子方程式H2S+2OH- =2S2-+H2O 。
(2)根据盖斯定律(①-②*2)/2=+172.5 kJ?mol-1
(3)使BaSO4得到充分的还原,提高BaS的产量
(4)①无论如何SO42-在溶液中的浓度都不能为0,错误;
②加入Na2SO4可以使溶液由a点变到b点,相当于增加了SO42-的浓度,此时溶液中钡离子浓度减小的,错误;
③?通过蒸发可以使溶液由d点变到c点,无论是SO42-的
本题难度:困难
5、简答题 四种短周期元素A、B、C、D的性质或结构信息如下.
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)①C元素在周期表中的位置______,请写出BC2分子的电子式______.
②A元素的单质与物质甲发生反应的离子方程式______.
③以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,写出电池的电极反应式.负极______;正极______
(2)A所在周期中,E元素的单质还原性最强,A、E单质反应得到的化合物M是一种重要的化工原料,如图是电解100ml饱和M溶液的装置,X、Y都是惰性电极,实验开始时,同时在两边各滴入几滴酚酞试液,则
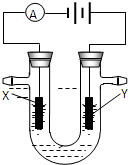
①电解池中Y极上的电极反应式______.检验Y电极反应产物的方法是______.
②电解一段时间后,若阴极收集到112ml标准状况下的气体,此时电解液的PH为______(假设电解液的体积保持不变,常温下)
参考答案:甲是地球上最常见的物质之一,是包括人类在内所有生命生存的重要
本题解析:
本题难度:一般