微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是[???? ]
A. 用铜片作阴、阳极,电解氯化铜溶液
B. 用铜片作阴、阳极,电解硫酸钾溶液
C. 铜锌合金在潮湿空气中发生电化学腐蚀
D. 铜片和碳棒用导线相连后同时插入一烧杯内的氯化钠溶液中
参考答案:B
本题解析:
本题难度:一般
2、填空题 (8分)(1998年上海)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为??????????????,与电源负极相连的电极附近,溶液pH?????????????(选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
????????????????????????????????、????????????????????????????????????。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以
是??????????(选填a,b,c多选扣分)。
a.Ba(OH)2 ???????b.Ba(NO3)2??????? c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为??????(选填a、b、c多选扣分)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过??????、冷却、??????????????(填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为???????????????????????????????????????????????????????????。
参考答案:(1)2Cl--2e_====Cl2;升高(2)Ca2++C
本题解析:略
本题难度:简单
3、填空题 (12分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g) △H1= +131kJ/mol
C(s)+O2(g)=CO2(g) △H2= —394kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H3= —283kJ/mol
则CO(g)+H2O(g) H2(g)+CO2(g)△H=
H2(g)+CO2(g)△H=
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) H2(g)+CO2(g),得到如下三组数据:
H2(g)+CO2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 反应达平衡时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 5
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
①实验l中以 CO2表示的反应速率为 。
②在900℃时,此反应的平衡常数K=
③若其它条件不变向实验2的平衡混合物中再加入0.4 mol H2O和0.4 mol CO2,达到新平衡时CO的转化率将 (变大、变小、不变)
(3)将标准状况下224mLCO2通入200mL 0.1 mol/L KOH溶液中,充分反应后得到溶液X,若不考虑溶液体积的变化,下列有关X的叙述不正确的是
A、c(OH-)=c(H+)+ c(HCO3—)+ 2c(H2CO3)
B、该溶液中,c(K+) > c(CO32—) > c(OH-) > c(HCO3—)> c(H+)
C、该溶液中,水电离出的c(OH-)大于水电离出的c(H+)
(4)以CO和O2为原料,用KOH作电解质组成燃料电池,则该电池负极的反应式为 。
若将该电池作电源,以石墨为电极电解硫酸铜溶液,当产生时0.64gCu,理论上至少需要消耗标况下的CO气体 mL
参考答案:(1)-41(2分)
(2)①0.16mol/(L·m
本题解析:
试题分析:(1)根据盖斯定律,所求热化学方程式的热效应△H=△H1-△H2+2△H3=+131kJ/mol-(—394kJ/mol)+2×(—283kJ/mol)=-41kJ/mol;
(2)①实验l中,CO的物质的量减少4-2.4=1.6mol,则二氧化碳的物质的量增加1.6mol,所以以 CO2表示的反应速率为1.6mol/2L/5min=0.16mol/(L·min);
②在900℃时,此反应平衡时c(CO)=1.6mol/2L=0.8mol/L,c(H2)= c(CO2)=0.4mol/2L=0.2mol/L,c(H2O)=(1-0.4)mol/2L=0.3mol/L,所以该温度的平衡常数K= c(H2)·c(CO2)/ c(CO)·c(H2O)=1/6;
③若其它条件不变向实验2的平衡混合物中再加入0.4 mol H2O和0.4 mol CO2,则c(CO2)=(0.4+0.4)mol/2L=0.4mol/L,c(H2O)=(1-0.4+0.4)mol/2L=0.5mol/L,则Qc=1/5>1/6,所以平衡逆向移动,则CO的转化率变小;
(3)标准状况下224mLCO2的物质的量是0.224L/22.4L/mol=0.01mol, 200mL 0.1 mol/L KOH溶液中KOH的物质的量是0.2L×0.1mol/L=0.02mol,所以二氧化碳与氢氧化钾反应生成碳酸钾和水。A、符合质子守恒定律,正确;B、碳酸钾溶液中,碳酸根离子水解,所以碳酸根离子浓度小于钾离子浓度,水解使溶液呈碱性,所以c(OH-) > c(HCO3—)> c(H+),所以c(K+) > c(CO32—) > c(OH-) > c(HCO3—)> c(H+),正确;C、水电离产生的氢氧根离子与氢离子的浓度始终相等,错误,答案选C;
(4)以CO和O2为原料,用KOH作电解质组成燃料电池,则负极发生氧化反应,CO发生氧化反应,与氢氧根离子结合生成碳酸根离子和水,电极反应式为CO-2e-+4OH-=CO32-+2H2O;以石墨为电极电解硫酸铜溶液,当产生时0.64gCu,Cu2++2e-==Cu,则转移电子的物质的量是0.64g/64g/mol×2=0.02mol,根据得失电子守恒,则需要CO在标准状况下的体积是0.02mol/2×22.4L/mol=224mL。
考点:考查盖斯定律的应用,化学平衡的移动,平衡常数的计算,离子浓度的比较,电化学反应原理的应用
本题难度:困难
4、填空题 O3可由臭氧发生器(原理如图)电解稀硫酸制得。
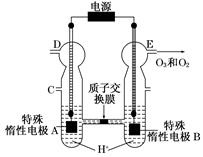
(1)图中阴极为???????(填“A”或“B”),其电极反应式为?????????????????。
(2)若C处通入O2,则A极的电极反应式为???????。
(3)若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为???????(忽略O3的分解)。
参考答案:(1)A 2H++2e-=H2↑
(2)O2+4H++
本题解析:观察电化学装置图知,特殊惰性电极B上产生了氧气和臭氧,该极失去电子发生氧化反应作阳极,则特殊惰性电极A为阴极,得电子发生还原反应,电极反应式为2H++2e-=H2↑;若从C处通入氧气,氧气将参与反应,阴极生成的将是水,电极反应为O2+4H++4e-=2H2O;设y L混合气体中臭氧的体积分数为a,由电子守恒有2x=y a×6+y (1-a)×4,解得a=(x-2y)/y。
本题难度:一般
5、选择题 下图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )

| a极板
| b极板
| x电极
| Z溶液
| A
| 锌
| 石墨
| 负极
| CuSO4
| B
| 石墨
| 石墨
| 负极
| NaOH
| C
| 银
| 铁
| 正极
| AgNO3
| D
| 铜
| 石墨
| 负极
| CuCl2
参考答案:A
本题解析:
试题分析:由于通电后a极板质量增加,b极板处有无色无臭气体放出,则说明a电极是阴极, b电极是阳极,X是负极,Y是正极,排除C选项,电解质溶液为活动性比H弱的金属的含氧酸盐溶液,则符合题意的只有选项A。
考点:考查电解原理应用的应用的知识。
本题难度:一般
|
|